nur für Forschungszwecke
Pilaralisib (XL147) PI3K Inhibitor
Kat.-Nr.S7645
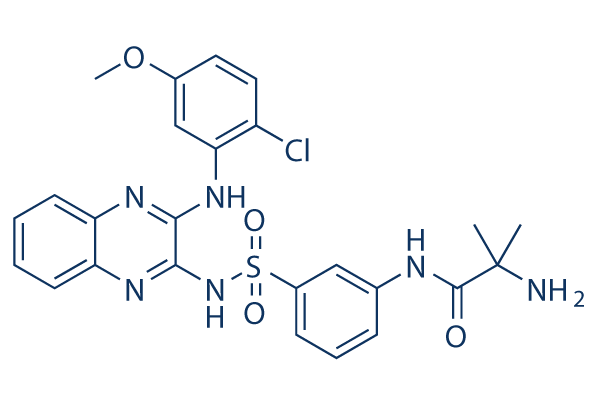
Chemische Struktur
Molekulargewicht: 541.02
Qualitätskontrolle
- In Nature Medicine für seine erstklassige Qualität zitiert
- COA
- NMR
- SDS
- Datenblatt
| Verwandte Ziele | Akt mTOR GSK-3 ATM/ATR DNA-PK AMPK PDPK1 PTEN PP2A PDK |
|---|---|
| Weitere PI3K Inhibitoren | GDC-0077 (Inavolisib) SAR405 Quercetin (Sophoretin) LY294002 XL147 analogue Tersolisib (STX-478) Buparlisib (BKM120) 740 Y-P (PDGFR 740Y-P) GO-203 TFA Eganelisib (IPI-549) |
Chemische Informationen, Lagerung & Stabilität
| Molekulargewicht | 541.02 | Formel | C25H25ClN6O4S |
Lagerung (Ab dem Eingangsdatum) | |
|---|---|---|---|---|---|
| CAS-Nr. | 934526-89-3 | SDF herunterladen | Lagerung von Stammlösungen |
|
|
| Synonyme | N/A | Smiles | CC(C)(C(=O)NC1=CC(=CC=C1)S(=O)(=O)NC2=NC3=CC=CC=C3N=C2NC4=C(C=CC(=C4)OC)Cl)N | ||
Löslichkeit
|
In vitro |
DMSO
: 100 mg/mL
(184.83 mM)
Water : Insoluble Ethanol : Insoluble |
Molaritätsrechner
|
In vivo |
|||||
In-vivo-Formulierungsrechner (Klare Lösung)
Schritt 1: Geben Sie die untenstehenden Informationen ein (Empfohlen: Ein zusätzliches Tier zur Berücksichtigung von Verlusten während des Experiments)
Schritt 2: Geben Sie die In-vivo-Formulierung ein (Dies ist nur der Rechner, keine Formulierung. Bitte kontaktieren Sie uns zuerst, wenn es im Abschnitt "Löslichkeit" keine In-vivo-Formulierung gibt.)
Berechnungsergebnisse:
Arbeitskonzentration: mg/ml;
Methode zur Herstellung der DMSO-Stammlösung: mg Wirkstoff vorgelöst in μL DMSO ( Konzentration der Stammlösung mg/mL, Bitte kontaktieren Sie uns zuerst, wenn die Konzentration die DMSO-Löslichkeit der Wirkstoffcharge überschreitet. )
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügenμL PEG300, mischen und klären, dann hinzufügenμL Tween 80, mischen und klären, dann hinzufügen μL ddH2O, mischen und klären.
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügen μL Maisöl, mischen und klären.
Hinweis: 1. Bitte stellen Sie sicher, dass die Flüssigkeit klar ist, bevor Sie das nächste Lösungsmittel hinzufügen.
2. Achten Sie darauf, das/die Lösungsmittel der Reihe nach hinzuzufügen. Sie müssen sicherstellen, dass die bei der vorherigen Zugabe erhaltene Lösung eine klare Lösung ist, bevor Sie mit der Zugabe des nächsten Lösungsmittels fortfahren. Physikalische Methoden wie Vortex, Ultraschall oder ein heißes Wasserbad können zur Unterstützung des Lösens verwendet werden.
Wirkmechanismus
| Targets/IC50/Ki |
PI3Kγ
23 nM
PI3Kβ
36 nM
PI3Kδ
36 nM
PI3Kα
39 nM
|
|---|---|
| In vitro |
In Zelllinien des Pediatric Preclinical Testing Program (PPTP) zeigt Pilaralisib (XL147) zytotoxische Aktivität mit einem medianen relativen IC50-Wert von 10,9 mM (Bereich 2,7 mM bis 24,5 mM).
|
| Kinase-Assay |
In-vitro-Kinase-Hemmtests
|
|
Die Kinaseaktivität für PI3K-Isoformen wird als Prozentsatz des verbrauchten ATP nach der Kinase-Reaktion unter Verwendung von Luciferase-Luciferin-gekoppelter Chemilumineszenz gemessen, wobei die ATP-Konzentrationen ungefähr dem Km für jede entsprechende Kinase entsprechen. Kinase-Reaktionen werden durch die Kombination von Testverbindungen, ATP und Kinase in einem Volumen von 20 μL initiiert. Die endgültigen Enzymkonzentrationen für PI3Kα, PI3Kβ, PI3Kγ und PI3Kδ betragen 0,5, 8, 20 bzw. 2 nM. Es ist zu beachten, dass 0,5 μL Dimethylsulfoxid (DMSO), das unterschiedliche Konzentrationen dieser Verbindung enthält, mit 10 μL Enzymlösung (2×Konzentration) gemischt wird. Kinase-Reaktionen werden durch die Zugabe von 10 μL Leberphosphatidylinositol- und ATP-Lösung (2×Konzentration) initiiert. Die Assay-Konzentrationen für VPS34, ATP und Phosphatidylinositol betragen 40 nM, 1 μM bzw. 5 μM.
|
|
| In vivo |
Bei BALB/c nu/nu Mäusen induziert Pilaralisib (XL147) (100 mg/kg, p.o.) eine Hemmung des Tumorwachstums bei soliden Gliom-Xenotransplantaten und wird gut vertragen, mit einer Toxizitätsrate von nur 0,7% in den behandelten Gruppen, ähnlich der bei Kontrolltieren beobachteten. Bei athymischen weiblichen Mäusen verzögert es (100 mg/kg, p.o.) das Tumorwachstum signifikant ohne signifikante medikamentenbedingte Toxizität.
|
Literatur |
|
Anwendungen
| Methoden | Biomarker | Bilder | PMID |
|---|---|---|---|
| Western blot | IGF-1R / AKT / MAPK |
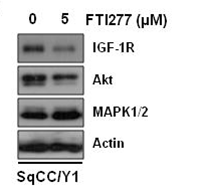
|
22113431 |
| Immunofluorescence | PAK phospho-PAK |
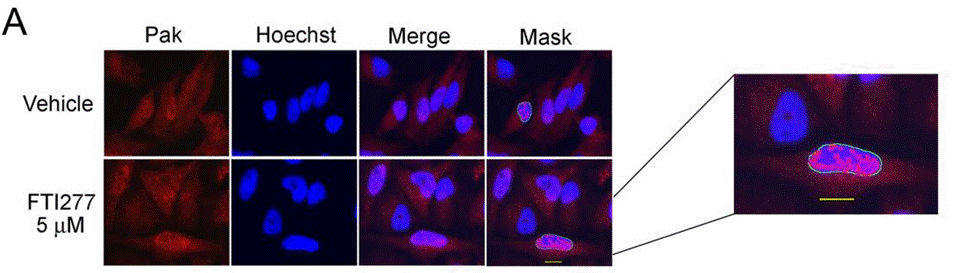
|
23915247 |
Klinische Studieninformationen
(Daten von https://clinicaltrials.gov, aktualisiert am 2024-05-22)
| NCT-Nummer | Rekrutierung | Erkrankungen | Sponsor/Kooperationspartner | Startdatum | Phasen |
|---|---|---|---|---|---|
| NCT01240460 | Completed | Glioblastoma|Astrocytoma Grade IV |
Sanofi |
January 2011 | Phase 1 |
| NCT01013324 | Completed | Endometrial Cancer|Endometrial Neoplasms |
Sanofi |
January 2010 | Phase 2 |
| NCT00756847 | Completed | Cancer|Non-Small Cell Lung Cancer|Endometrial Carcinoma|Ovarian Carcinoma |
Sanofi |
September 2008 | Phase 1 |
| NCT00704392 | Withdrawn | Cancer|Non-small-cell Lung Cancer|Breast Cancer |
Exelixis |
June 2008 | Phase 1 |
Technischer Support
Tel: +1-832-582-8158 Ext:3
Wenn Sie weitere Fragen haben, hinterlassen Sie bitte eine Nachricht.
