nur für Forschungszwecke
Ropinirole HCl Dopamine Receptor Inhibitor
Kat.-Nr.S3189
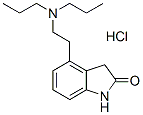
Chemische Struktur
Molekulargewicht: 296.84
Qualitätskontrolle
| Verwandte Ziele | Adrenergic Receptor AChR 5-HT Receptor COX Calcium Channel Histamine Receptor GABA Receptor TRP Channel Cholinesterase (ChE) GluR |
|---|---|
| Weitere Dopamine Receptor Inhibitoren | MPTP Hydrochloride Trifluoperazine Trifluoperazine 2HCl Penfluridol Sulpiride Levosulpiride SCH-23390 hydrochloride Domperidone Rotundine Azaperone |
Chemische Informationen, Lagerung & Stabilität
| Molekulargewicht | 296.84 | Formel | C16H24N2O.HCl |
Lagerung (Ab dem Eingangsdatum) | |
|---|---|---|---|---|---|
| CAS-Nr. | 91374-20-8 | SDF herunterladen | Lagerung von Stammlösungen |
|
|
| Synonyme | SKF-101468A | Smiles | CCCN(CCC)CCC1=C2CC(=O)NC2=CC=C1.Cl | ||
Löslichkeit
|
In vitro |
Water : 59 mg/mL
DMSO
: 30 mg/mL
(101.06 mM)
Ethanol : Insoluble |
Molaritätsrechner
|
In vivo |
|||||
In-vivo-Formulierungsrechner (Klare Lösung)
Schritt 1: Geben Sie die untenstehenden Informationen ein (Empfohlen: Ein zusätzliches Tier zur Berücksichtigung von Verlusten während des Experiments)
Schritt 2: Geben Sie die In-vivo-Formulierung ein (Dies ist nur der Rechner, keine Formulierung. Bitte kontaktieren Sie uns zuerst, wenn es im Abschnitt "Löslichkeit" keine In-vivo-Formulierung gibt.)
Berechnungsergebnisse:
Arbeitskonzentration: mg/ml;
Methode zur Herstellung der DMSO-Stammlösung: mg Wirkstoff vorgelöst in μL DMSO ( Konzentration der Stammlösung mg/mL, Bitte kontaktieren Sie uns zuerst, wenn die Konzentration die DMSO-Löslichkeit der Wirkstoffcharge überschreitet. )
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügenμL PEG300, mischen und klären, dann hinzufügenμL Tween 80, mischen und klären, dann hinzufügen μL ddH2O, mischen und klären.
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügen μL Maisöl, mischen und klären.
Hinweis: 1. Bitte stellen Sie sicher, dass die Flüssigkeit klar ist, bevor Sie das nächste Lösungsmittel hinzufügen.
2. Achten Sie darauf, das/die Lösungsmittel der Reihe nach hinzuzufügen. Sie müssen sicherstellen, dass die bei der vorherigen Zugabe erhaltene Lösung eine klare Lösung ist, bevor Sie mit der Zugabe des nächsten Lösungsmittels fortfahren. Physikalische Methoden wie Vortex, Ultraschall oder ein heißes Wasserbad können zur Unterstützung des Lösens verwendet werden.
Wirkmechanismus
| Targets/IC50/Ki |
D2 receptor
29 nM(Ki)
|
|---|---|
| In vitro |
Ropinirole fängt freie Radikale ab und unterdrückt die Lipidperoxidation im Fe2+–H2O2-Reaktionssystem.
|
| In vivo |
Ropinirole (50 mg/kg, i.p.) verursacht eine biphasische spontane lokomotorische Aktivität bei Mäusen. Ropinirole (0,05-1,0 mg/kg SC) hemmt dosisabhängig die durch 2-Di-n-propylamino-5,6-dihydroxytetralin induzierten Dyskinesien bei Mäusen. Ropinirole, in Dosen von 1 und 10 μg, unilateral direkt in das Striatum der Ratte injiziert, verursacht eine ausgeprägte, kontralaterale (von der Injektionsseite weg) Asymmetrie und Zirkumduktion bei Mäusen. Ropinirole (0,05-1,0 mg/kg SC oder 0,1 mg/kg PO) kehrt alle durch MPTP induzierten motorischen und Verhaltensdefizite bei Marmosetten um. Ropinirole (2 mg/kg, i.p.) für 7 Tage erhöht GSH-, Katalase- und SOD-Aktivitäten im Striatum und schützt striatale dopaminerge Neuronen vor 6-Hydroxydopamin (6-OHDA) bei Mäusen. Ropinirole (0,2 mg/kg, i.p.) verbessert die Nutzung der zuvor akinetischen Vordergliedmaße und erzeugte ein robustes zirkuläres Verhalten bei läsionierten Ratten mit striataler Überexpression von sowohl D2R als auch D3R im Vergleich zu läsionierten Tieren, die einen leeren Vektor erhielten. Die subtherapeutische Dosis von Ropinirole erzeugt nur bescheidene motorische Effekte bei läsionierten Ratten mit alleiniger Überexpression von D2R oder D3R. Ropinirole (1-8 mg t.i.d.) wird schnell und vollständig resorbiert mit einer oralen Bioverfügbarkeit von 55 %, einer Clearance von 780 ml/min und einer Eliminationshalbwertszeit von 6 Stunden bei gesunden Probanden. Da der Haupteliminierungsweg für Ropinirole über das CYP-Enzymsystem erfolgt, hauptsächlich über CYP1A2 und auch über CYP3A4, kann die Hemmung des ersteren und möglicherweise des letzteren die Clearance des Wirkstoffs reduzieren und zu einer Arzneimittelakkumulation führen. Die Behandlung mit Ropinirole (0,25 mg-4,0 mg pro Tag) verbessert die Fähigkeit der Patienten, den Schlaf einzuleiten, die Menge des Schlafstadiums 2 und die Schlafadäquanz signifikant im Vergleich zu Placebo. Periodische Gliedmaßenbewegungen mit Arousal pro Stunde nehmen mit Ropinirole von 7,0 auf 2,5 ab, nehmen aber mit Placebo von 4,2 auf 6,0 zu. Periodische Gliedmaßenbewegungen im Wachzustand pro Stunde nehmen mit Ropinirole von 56,5 auf 23,6 ab, nehmen aber mit Placebo von 46,6 auf 56,1 zu.
|
Literatur |
|
Klinische Studieninformationen
(Daten von https://clinicaltrials.gov, aktualisiert am 2024-05-22)
| NCT-Nummer | Rekrutierung | Erkrankungen | Sponsor/Kooperationspartner | Startdatum | Phasen |
|---|---|---|---|---|---|
| NCT03708237 | Terminated | Restless Legs Syndrome|End Stage Renal Disease |
University of Alberta |
February 19 2019 | Phase 2 |
| NCT03250117 | Terminated | Parkinson Disease |
Titan Pharmaceuticals |
October 10 2017 | Phase 1|Phase 2 |
| NCT00823836 | Completed | Parkinson Disease |
GlaxoSmithKline |
March 2009 | Phase 3 |
| NCT00530790 | Completed | Restless Legs Syndrome |
GlaxoSmithKline |
August 23 2007 | Phase 2 |
| NCT00460148 | Completed | Parkinson Disease |
GlaxoSmithKline |
April 2007 | Phase 2 |
Technischer Support
Tel: +1-832-582-8158 Ext:3
Wenn Sie weitere Fragen haben, hinterlassen Sie bitte eine Nachricht.
