nur für Forschungszwecke
Tenalisib PI3K Inhibitor
Kat.-Nr.S8672
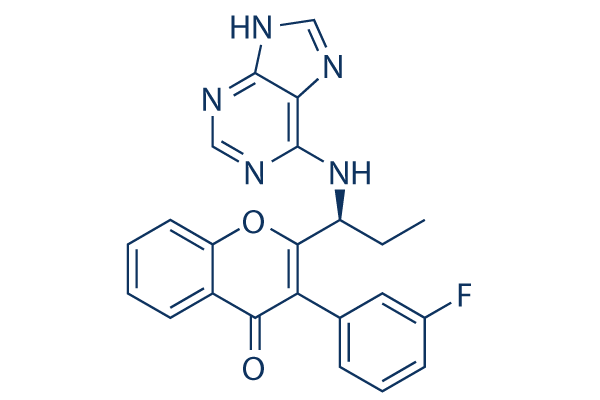
Chemische Struktur
Molekulargewicht: 415.42
Qualitätskontrolle
| Verwandte Ziele | Akt mTOR GSK-3 ATM/ATR DNA-PK AMPK PDPK1 PTEN PP2A PDK |
|---|---|
| Weitere PI3K Inhibitoren | GDC-0077 (Inavolisib) SAR405 Quercetin (Sophoretin) LY294002 XL147 analogue Tersolisib (STX-478) Buparlisib (BKM120) 740 Y-P (PDGFR 740Y-P) GO-203 TFA Eganelisib (IPI-549) |
Chemische Informationen, Lagerung & Stabilität
| Molekulargewicht | 415.42 | Formel | C23H18FN5O2 |
Lagerung (Ab dem Eingangsdatum) | |
|---|---|---|---|---|---|
| CAS-Nr. | 1639417-53-0 | -- | Lagerung von Stammlösungen |
|
|
| Synonyme | RP6530 | Smiles | CCC(C1=C(C(=O)C2=CC=CC=C2O1)C3=CC(=CC=C3)F)NC4=NC=NC5=C4NC=N5 | ||
Löslichkeit
|
In vitro |
DMSO
: 50 mg/mL
(120.36 mM)
Ethanol : 14 mg/mL Water : Insoluble |
Molaritätsrechner
|
In vivo |
|||||
In-vivo-Formulierungsrechner (Klare Lösung)
Schritt 1: Geben Sie die untenstehenden Informationen ein (Empfohlen: Ein zusätzliches Tier zur Berücksichtigung von Verlusten während des Experiments)
Schritt 2: Geben Sie die In-vivo-Formulierung ein (Dies ist nur der Rechner, keine Formulierung. Bitte kontaktieren Sie uns zuerst, wenn es im Abschnitt "Löslichkeit" keine In-vivo-Formulierung gibt.)
Berechnungsergebnisse:
Arbeitskonzentration: mg/ml;
Methode zur Herstellung der DMSO-Stammlösung: mg Wirkstoff vorgelöst in μL DMSO ( Konzentration der Stammlösung mg/mL, Bitte kontaktieren Sie uns zuerst, wenn die Konzentration die DMSO-Löslichkeit der Wirkstoffcharge überschreitet. )
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügenμL PEG300, mischen und klären, dann hinzufügenμL Tween 80, mischen und klären, dann hinzufügen μL ddH2O, mischen und klären.
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügen μL Maisöl, mischen und klären.
Hinweis: 1. Bitte stellen Sie sicher, dass die Flüssigkeit klar ist, bevor Sie das nächste Lösungsmittel hinzufügen.
2. Achten Sie darauf, das/die Lösungsmittel der Reihe nach hinzuzufügen. Sie müssen sicherstellen, dass die bei der vorherigen Zugabe erhaltene Lösung eine klare Lösung ist, bevor Sie mit der Zugabe des nächsten Lösungsmittels fortfahren. Physikalische Methoden wie Vortex, Ultraschall oder ein heißes Wasserbad können zur Unterstützung des Lösens verwendet werden.
Wirkmechanismus
| Targets/IC50/Ki |
PI3Kδ
(Cell-free assay) 24.5 nM
PI3Kγ
(Cell-free assay) 33.2 nM
|
|---|---|
| In vitro |
RP6530 ist ein spezifischer dualer PI3K-δ/γ-Inhibitor, der eine mehrfache Selektivität gegenüber den anderen PI3K-Isoformen und 245-Kinasen aufweist. RP6530 bewirkt eine dosisabhängige Hemmung (>50 % bei 2-7 μM) des Wachstums von immortalisierten (Raji, TOLEDO, KG-1, JEKO, REC-1) B-Zell-Lymphomzellen. Der Effekt ist ausgeprägter in den DLBCL-Zelllinien OCI-LY-1 und OCI-LY-10 (>50 % Hemmung bei 0,1-0,7 μM), und die Reduktion der Viabilität wird von einer entsprechenden Hemmung von pAKT mit EC50 von 6 bzw. 70 nM begleitet. Die Behandlung von primären Zellen, die von Patienten stammen, mit 4 µM RP6530 führt zu einer Zunahme des Zelltods. Zellen in früher Apoptose (Annexin V+/PI-) unterscheiden sich nicht zwischen der DMSO-Leerprobe und den RP6530-Proben. RP6530 zeigt eine potente Hemmwirkung auf Krebsstammzellen in Eierstockkrebszelllinien. Die Behandlung mit 1 μM RP6530 führt zu einem G2/M-Arrest in den MM-1S- und MM-1R-Linien mit sehr wenigen Zellen in der SubG0-Phase. Sie führt auch zu einer 70-90%igen Hemmung von pAKT in den MM-1S- und MM-1R-Zelllinien. Die potente Modulation der Entzündungsreaktion durch RP6530 trägt zur Kontrolle des Tumormikromilieus bei.
|
| In vivo |
Die vorhergesagten T1/2, Cmax und AUC0-t bei einer Dosis von 10 mg beim Menschen betragen 9,5 h, 14,0 μM bzw. 342,0 μM. RP6530 hat ein exzellentes pharmakokinetisches Profil mit Plasmakonzentrationen, die bei Dosen von nur 3 mg/kg bei Ratten und Hunden 6-12 h lang deutlich über der EC75 liegen. Darüber hinaus zeigt RP6530 eine orale Bioverfügbarkeit von >70 und >100 % mit einer Halbwertszeit von 2 bzw. 3 h bei Ratten und Hunden.
|
Literatur |
|
Klinische Studieninformationen
(Daten von https://clinicaltrials.gov, aktualisiert am 2024-05-22)
| NCT-Nummer | Rekrutierung | Erkrankungen | Sponsor/Kooperationspartner | Startdatum | Phasen |
|---|---|---|---|---|---|
| NCT06189209 | Recruiting | Triple Negative Breast Cancer (TNBC) |
Rhizen Pharmaceuticals SA|Incozen Therapeutics Pvt Ltd |
March 4 2024 | Phase 2 |
| NCT03770000 | Completed | T Cell Lymphoma |
Rhizen Pharmaceuticals SA |
March 12 2019 | Phase 1|Phase 2 |
| NCT03471351 | Terminated | Classical Hodgkin Lymphoma |
Rhizen Pharmaceuticals SA |
July 18 2018 | Phase 1 |
| NCT02567656 | Completed | Lymphoma T-Cell Peripheral|Lymphoma T-Cell Cutaneous |
Rhizen Pharmaceuticals SA |
September 2015 | Phase 1 |
| NCT02017613 | Completed | Lymphoma B-Cell|T-Cell Lymphoma |
Rhizen Pharmaceuticals SA |
November 2013 | Phase 1 |
Technischer Support
Tel: +1-832-582-8158 Ext:3
Wenn Sie weitere Fragen haben, hinterlassen Sie bitte eine Nachricht.
