nur für Forschungszwecke
Tolvaptan Vasopressin Receptor Antagonist
Kat.-Nr.S2593
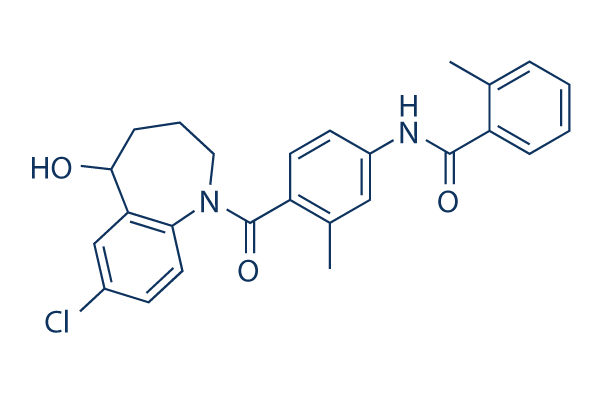
Chemische Struktur
Molekulargewicht: 448.94
Qualitätskontrolle
| Verwandte Ziele | CXCR Hedgehog/Smoothened PKA Adrenergic Receptor AChR 5-HT Receptor Histamine Receptor Dopamine Receptor Ras KRas |
|---|---|
| Weitere Vasopressin Receptor Inhibitoren | Mozavaptan RO 5028442 (RG7713) Lixivaptan (VPA-985) Mozavaptan (hydrochloride) |
Chemische Informationen, Lagerung & Stabilität
| Molekulargewicht | 448.94 | Formel | C26H25ClN2O3 |
Lagerung (Ab dem Eingangsdatum) | |
|---|---|---|---|---|---|
| CAS-Nr. | 150683-30-0 | SDF herunterladen | Lagerung von Stammlösungen |
|
|
| Synonyme | OPC-41061 | Smiles | CC1=CC=CC=C1C(=O)NC2=CC(=C(C=C2)C(=O)N3CCCC(C4=C3C=CC(=C4)Cl)O)C | ||
Löslichkeit
|
In vitro |
DMSO
: 90 mg/mL
(200.47 mM)
Water : Insoluble Ethanol : Insoluble |
Molaritätsrechner
|
In vivo |
|||||
In-vivo-Formulierungsrechner (Klare Lösung)
Schritt 1: Geben Sie die untenstehenden Informationen ein (Empfohlen: Ein zusätzliches Tier zur Berücksichtigung von Verlusten während des Experiments)
Schritt 2: Geben Sie die In-vivo-Formulierung ein (Dies ist nur der Rechner, keine Formulierung. Bitte kontaktieren Sie uns zuerst, wenn es im Abschnitt "Löslichkeit" keine In-vivo-Formulierung gibt.)
Berechnungsergebnisse:
Arbeitskonzentration: mg/ml;
Methode zur Herstellung der DMSO-Stammlösung: mg Wirkstoff vorgelöst in μL DMSO ( Konzentration der Stammlösung mg/mL, Bitte kontaktieren Sie uns zuerst, wenn die Konzentration die DMSO-Löslichkeit der Wirkstoffcharge überschreitet. )
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügenμL PEG300, mischen und klären, dann hinzufügenμL Tween 80, mischen und klären, dann hinzufügen μL ddH2O, mischen und klären.
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügen μL Maisöl, mischen und klären.
Hinweis: 1. Bitte stellen Sie sicher, dass die Flüssigkeit klar ist, bevor Sie das nächste Lösungsmittel hinzufügen.
2. Achten Sie darauf, das/die Lösungsmittel der Reihe nach hinzuzufügen. Sie müssen sicherstellen, dass die bei der vorherigen Zugabe erhaltene Lösung eine klare Lösung ist, bevor Sie mit der Zugabe des nächsten Lösungsmittels fortfahren. Physikalische Methoden wie Vortex, Ultraschall oder ein heißes Wasserbad können zur Unterstützung des Lösens verwendet werden.
Wirkmechanismus
| Targets/IC50/Ki |
vasopressin receptor 2
3 nM
|
|---|---|
| In vitro |
Tolvaptan blockiert die Bindung von [(3)H]AVP an menschliche V(2)-Rezeptoren mit einer 29-fach höheren Selektivität als an V(1a)-Rezeptoren und zeigte keine Hemmung von V(1b)-Rezeptoren. Diese Verbindung hemmt nicht nur die Bindung von [(3)H]AVP, sondern auch die AVP-induzierte Produktion von zyklischem AMP in menschlichen V(2)-Rezeptor-exprimierenden HeLa-Zellen. Es zeigt eine deutliche Aquaresis bei gesunden und kranken Tieren. Diese Chemikalie verursacht eine konzentrationsabhängige Hemmung der Arginin-Vasopressin-induzierten cAMP-Produktion mit einem scheinbaren IC(50) von 0,1 nM in Zellen der autosomal-dominanten polyzystischen Nierenerkrankung (ADPKD). Es hemmt die AVP-induzierte ERK-Signalübertragung und Zellproliferation. Diese Verbindung hemmt auch die AVP-induzierte Cl(-)-Sekretion und verringert das In-vitro-Zystenwachstum von ADPKD-Zellen, die in einer dreidimensionalen Kollagenmatrix kultiviert werden.
|
| In vivo |
Tolvaptan verbessert Hyponatriämie, was zur Verhinderung des Todes führt, und verbessert die Organwasserretention in Rattenmodellen mit akuter und chronischer Hyponatriämie. Diese Verbindung reduziert die kardiale Vorlast ohne nachteilige Auswirkungen auf Nierenfunktionen, systemische Hämodynamik oder zirkulierende Neurohormone bei Hunden mit Herzinsuffizienz (HF). Es zeigt eine Abnahme des Nierengewichts sowie des Zysten- und Fibrosevolumens in Tiermodellen der menschlichen polyzystischen Nierenerkrankung (PKD). Dieses Mittel erhöht die elektrolytfreie Wasserclearance (E-CH(2)O) oder Aquaresis deutlich auf einen positiven Wert und erhöht die renale Arginin-Vasopressin (AVP)-Ausscheidung bei Ratten mit Herzinsuffizienz.
|
Literatur |
|
Klinische Studieninformationen
(Daten von https://clinicaltrials.gov, aktualisiert am 2024-05-22)
| NCT-Nummer | Rekrutierung | Erkrankungen | Sponsor/Kooperationspartner | Startdatum | Phasen |
|---|---|---|---|---|---|
| NCT06171100 | Recruiting | Hyponatremia|SIADH |
King''s College Hospital NHS Trust |
March 15 2024 | -- |
| NCT04182958 | Completed | Healthy Adult Male |
Otsuka Pharmaceutical Co. Ltd. |
November 25 2019 | Phase 1 |
| NCT02994394 | Completed | Healthy Adult Male |
Otsuka Pharmaceutical Co. Ltd. |
January 6 2017 | Phase 1 |
| NCT02729662 | Unknown status | Autosomal Dominant Polycystic Kidney Disease |
Kyorin University |
October 1 2016 | Not Applicable |
| NCT02020278 | Terminated | Hyponatremia |
Otsuka Pharmaceutical Development & Commercialization Inc.|Syneos Health |
April 22 2016 | Phase 3 |
Technischer Support
Tel: +1-832-582-8158 Ext:3
Wenn Sie weitere Fragen haben, hinterlassen Sie bitte eine Nachricht.
