nur für Forschungszwecke
Atazanavir (BMS-232632) Sulfate HIV Protease Inhibitor
Kat.-Nr.S1457
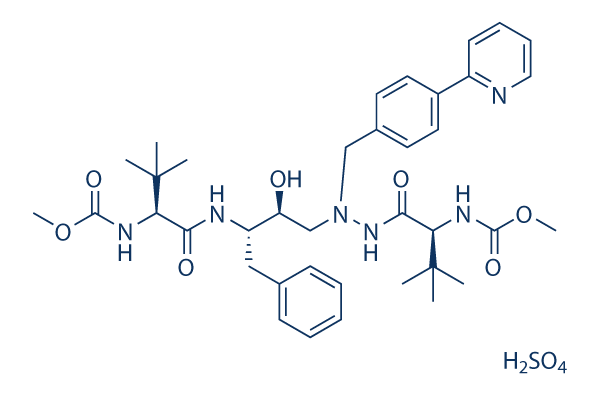
Chemische Struktur
Molekulargewicht: 802.93
Qualitätskontrolle
| Verwandte Ziele | HDAC Caspase Proteasome Secretase MMP HCV Protease Cysteine Protease DPP Tyrosinase Serine Protease |
|---|---|
| Weitere HIV Protease Inhibitoren | Pepstatin A Limonin Temsavir (BMS-626529) NBD-556 Bevirimat GS-6207 Rosamultin Dextran sulfate sodium (DSS) Mericitabine Azvudine |
Chemische Informationen, Lagerung & Stabilität
| Molekulargewicht | 802.93 | Formel | C38H52N6O7.H2SO4 |
Lagerung (Ab dem Eingangsdatum) | |
|---|---|---|---|---|---|
| CAS-Nr. | 229975-97-7 | -- | Lagerung von Stammlösungen |
|
|
| Synonyme | BMS-232632-05, Reyataz | Smiles | CC(C)(C)C(C(=O)NC(CC1=CC=CC=C1)C(CN(CC2=CC=C(C=C2)C3=CC=CC=N3)NC(=O)C(C(C)(C)C)NC(=O)OC)O)NC(=O)OC.OS(=O)(=O)O | ||
Löslichkeit
|
In vitro |
DMSO
: 100 mg/mL
(124.54 mM)
Water : Insoluble Ethanol : Insoluble |
Molaritätsrechner
|
In vivo |
|||||
In-vivo-Formulierungsrechner (Klare Lösung)
Schritt 1: Geben Sie die untenstehenden Informationen ein (Empfohlen: Ein zusätzliches Tier zur Berücksichtigung von Verlusten während des Experiments)
Schritt 2: Geben Sie die In-vivo-Formulierung ein (Dies ist nur der Rechner, keine Formulierung. Bitte kontaktieren Sie uns zuerst, wenn es im Abschnitt "Löslichkeit" keine In-vivo-Formulierung gibt.)
Berechnungsergebnisse:
Arbeitskonzentration: mg/ml;
Methode zur Herstellung der DMSO-Stammlösung: mg Wirkstoff vorgelöst in μL DMSO ( Konzentration der Stammlösung mg/mL, Bitte kontaktieren Sie uns zuerst, wenn die Konzentration die DMSO-Löslichkeit der Wirkstoffcharge überschreitet. )
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügenμL PEG300, mischen und klären, dann hinzufügenμL Tween 80, mischen und klären, dann hinzufügen μL ddH2O, mischen und klären.
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügen μL Maisöl, mischen und klären.
Hinweis: 1. Bitte stellen Sie sicher, dass die Flüssigkeit klar ist, bevor Sie das nächste Lösungsmittel hinzufügen.
2. Achten Sie darauf, das/die Lösungsmittel der Reihe nach hinzuzufügen. Sie müssen sicherstellen, dass die bei der vorherigen Zugabe erhaltene Lösung eine klare Lösung ist, bevor Sie mit der Zugabe des nächsten Lösungsmittels fortfahren. Physikalische Methoden wie Vortex, Ultraschall oder ein heißes Wasserbad können zur Unterstützung des Lösens verwendet werden.
Wirkmechanismus
| Merkmale |
Atazanavir is generally more potent than other HIV-1 Prt inhibitors, including IDV, SQV, RTV, NFV, and APV.
|
|---|---|
| Targets/IC50/Ki |
HIV protease
(Cell-free assay) 2.66 nM(Ki)
|
| In vitro |
Atazanavir hemmt die proteolytische Spaltung des viralen Gag-Vorläufers p55 Polyprotein mit einer IC50 von ~47 nM in virusinfizierten H9-Zellen. Atazanavir zeigt eine potente antivirale Aktivität mit einer EC50 von 3,89 nM in RF/MT-2-Stämmen. . Atazanavir ist ein Inhibitor der Bilirubin-Glucuronidierung mit einer IC50 von 2,4 μM. Atazanavir hemmt die rekombinante UGT1A1 mit einem Ki von 1,9 μM. Atazanavir hemmt das Zellwachstum in U251-, T98G- und LN229-Glioblastom-Zelllinien, mit auffallend erhöhten GRP78- und CHOP-Proteinspiegeln. Atazanavir verursacht eine deutliche Zunahme polyubiquitinierter Proteine verschiedener Größen in U251-Glioblastomzellen. Atazanavir hemmt auch das menschliche 20S Proteasom mit einer IC50 von 26 μM. Atazanavir (30 μM) verändert die Stärke des ER-Stresses und der UPR-Genexpression in HepG2-Zellen. Atazanavir (30 mM) führt zu einem 2,5-fachen Anstieg der immunoreaktiven P-gp-Expression mit vermindertem intrazellulärem Rh123 in LS180V-Zellen. |
| Kinase-Assay |
Protease assays
|
|
Zur Bestimmung der Inhibitionskonstanten (Ki) für jeden Prt-Inhibitor wird gereinigtes HIV-1 RF Wildtyp Prt (2,5 nM) bei 37 ℃ mit 1 μM bis 15 μM fluorogenem Substrat in Reaktionspuffer (1 M NaCl, 1 mM EDTA, 0,1 M Natriumacetat [pH 5,5], 0,1 % Polyethylenglykol 8000) in An- oder Abwesenheit von Atazanavir inkubiert. Die Spaltung des Substrats wird durch Messung eines Anstiegs der Fluoreszenzemission bei 490 nM nach Anregung bei 340 nM unter Verwendung eines Cytofluor 4000 quantifiziert. Die Reaktionen werden unter Verwendung von 1,36 μM, 1,66 μM, 2,1 μM, 3,0 μM, 5,0 μM oder 15 μM Substrat in Anwesenheit von fünf Konzentrationen von Atazanavir (1,25 nM bis 25 nM) durchgeführt. Die Substratspaltung wird in 5-minütigen Intervallen für 30 min überwacht. Die Spaltungsraten werden dann für jede Probe zu frühen Zeitpunkten der Reaktion bestimmt, und die Ki-Werte werden aus den Steigungen der resultierenden Michaelis-Menten-Diagramme ermittelt.
|
Literatur |
|
Technischer Support
Tel: +1-832-582-8158 Ext:3
Wenn Sie weitere Fragen haben, hinterlassen Sie bitte eine Nachricht.
