nur für Forschungszwecke
Chlorpheniramine Maleate Histamine Receptor Antagonist
Kat.-Nr.S1816
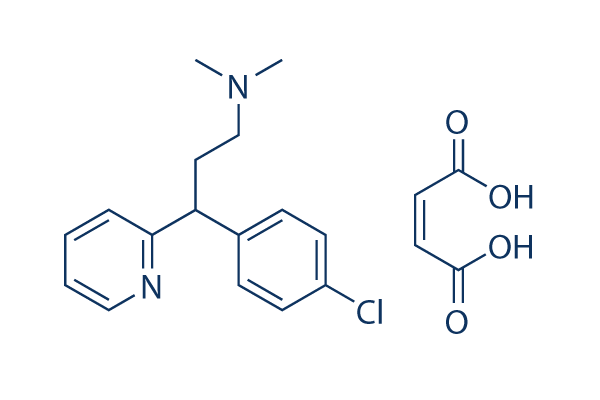
Chemische Struktur
Molekulargewicht: 390.86
Qualitätskontrolle
- In Nature Medicine für seine erstklassige Qualität zitiert
- COA
- NMR
- SDS
- Datenblatt
| Verwandte Ziele | Adrenergic Receptor AChR 5-HT Receptor COX Calcium Channel Dopamine Receptor GABA Receptor TRP Channel Cholinesterase (ChE) GluR |
|---|---|
| Weitere Histamine Receptor Inhibitoren | GSK2879552 Dihydrochloride JNJ-7777120 Ebastine Ciproxifan Maleate Mianserin HCl Astemizole Lafutidine Mizolastine Rupatadine Fumarate Betahistine 2HCl |
Chemische Informationen, Lagerung & Stabilität
| Molekulargewicht | 390.86 | Formel | C16H19ClN2.C4H4O4 |
Lagerung (Ab dem Eingangsdatum) | |
|---|---|---|---|---|---|
| CAS-Nr. | 113-92-8 | SDF herunterladen | Lagerung von Stammlösungen |
|
|
| Synonyme | NCI-C55265 | Smiles | CN(C)CCC(C1=CC=C(C=C1)Cl)C2=CC=CC=N2.C(=CC(=O)O)C(=O)O | ||
Löslichkeit
|
In vitro |
DMSO
: 78 mg/mL
(199.55 mM)
Water : 78 mg/mL Ethanol : 78 mg/mL |
Molaritätsrechner
|
In vivo |
|||||
In-vivo-Formulierungsrechner (Klare Lösung)
Schritt 1: Geben Sie die untenstehenden Informationen ein (Empfohlen: Ein zusätzliches Tier zur Berücksichtigung von Verlusten während des Experiments)
Schritt 2: Geben Sie die In-vivo-Formulierung ein (Dies ist nur der Rechner, keine Formulierung. Bitte kontaktieren Sie uns zuerst, wenn es im Abschnitt "Löslichkeit" keine In-vivo-Formulierung gibt.)
Berechnungsergebnisse:
Arbeitskonzentration: mg/ml;
Methode zur Herstellung der DMSO-Stammlösung: mg Wirkstoff vorgelöst in μL DMSO ( Konzentration der Stammlösung mg/mL, Bitte kontaktieren Sie uns zuerst, wenn die Konzentration die DMSO-Löslichkeit der Wirkstoffcharge überschreitet. )
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügenμL PEG300, mischen und klären, dann hinzufügenμL Tween 80, mischen und klären, dann hinzufügen μL ddH2O, mischen und klären.
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügen μL Maisöl, mischen und klären.
Hinweis: 1. Bitte stellen Sie sicher, dass die Flüssigkeit klar ist, bevor Sie das nächste Lösungsmittel hinzufügen.
2. Achten Sie darauf, das/die Lösungsmittel der Reihe nach hinzuzufügen. Sie müssen sicherstellen, dass die bei der vorherigen Zugabe erhaltene Lösung eine klare Lösung ist, bevor Sie mit der Zugabe des nächsten Lösungsmittels fortfahren. Physikalische Methoden wie Vortex, Ultraschall oder ein heißes Wasserbad können zur Unterstützung des Lösens verwendet werden.
Wirkmechanismus
| Targets/IC50/Ki |
Histamine H1 receptor
12 nM
|
|---|---|
| In vitro |
Chlorpheniramine hemmt die [3H]Mepyramin-Bindung an den Histamine Receptor H1 im Meerschweinchengehirn mit einer IC50 von 8,8 nM. Chlorpheniramine hemmt die Proliferation von MCF-7-, MDA-MB 231- und Ehrlich-Zellen dosisabhängig und reduziert die Ornithindecarboxylase-mRNA-Translation bei 250 μM signifikant um 50 % bis 70 %. Chlorpheniramine verdrängt [3H]Pyrilamin von menschlichen Histamine Receptor-Subtyp 1, der in CHO-Zellen exprimiert wird, mit einer IC50 von 66 nM. Chlorpheniramine zeigt antimalarische Aktivität gegen CQS-Stamm (D6) und MDR-Stamm (Dd2) von P. falciparum mit einer IC50 von 61,2 uM bzw. 3,9 uM. Chlorpheniramine zeigt Zytotoxizität gegen die Proliferation von Concanavalin A-induzierten murinen Milzlymphozyten mit einer IC50 von 33,4 μM. Die Behandlung menschlicher Speicheldrüsenzellen mit Chlorpheniramine hemmt den Histamin-induzierten [Ca2+]i-Anstieg in einer konzentrationsabhängigen Weise mit einer IC50 von 128 nM signifikanter als den Carbachol-induzierten [Ca2+]i-Anstieg mit einer IC50 von 43,9 μM.
|
| Kinase-Assay |
H1-Antihistaminische Aktivität
|
|
Die (1 cm) Segmente des isolierten Ileums von Meerschweinchen werden in einem Organbad, das Tyrode-Lösung enthält (Belüftung, 32 °C), suspendiert. Die kontraktilen Reaktionen auf Histamin (0,54 μM) werden mit einem isotonischen Transducer gemessen. Eine festgelegte Konzentration von Chlorpheniramine wird 5 Minuten vor der Zugabe von Histamin in das Organbad gegeben. Der IC50-Wert von Chlorpheniramine wird mit der Probit-Methode berechnet.
|
|
| In vivo |
Die orale Verabreichung von Chlorpheniramine hemmt die Histamin-induzierte Mortalität bei Meerschweinchen mit einer ED50 von 0,17 mg/kg. Die orale Verabreichung von Chlorpheniramine (10 mg/kg) hemmt signifikant das Kurzzeitkratzen bei BALB/c-Mäusen, stimuliert durch Ovalbumin-aktive kutane Anaphylaxie, und bei ICR-Mäusen, denen subkutan Histamin injiziert wurde, jedoch nicht das Langzeitkratzen bei NC/Nga-Mäusen, im Gegensatz zu Dexamethason oder Tacrolimus. Die Verabreichung von Chlorpheniramine (20 mg/kg) hebt den Anstieg des REM-Schlafs bei Ratten, der durch Immobilisierungsstress induziert wird, aufgrund der Blockade der histaminergen und cholinergen Mechanismen, die den REM-Schlaf erzeugen, signifikant auf.
|
Literatur |
|
Technischer Support
Tel: +1-832-582-8158 Ext:3
Wenn Sie weitere Fragen haben, hinterlassen Sie bitte eine Nachricht.
