nur für Forschungszwecke
Rupatadine Fumarate Histamine Receptor Inhibitor
Kat.-Nr.S3052
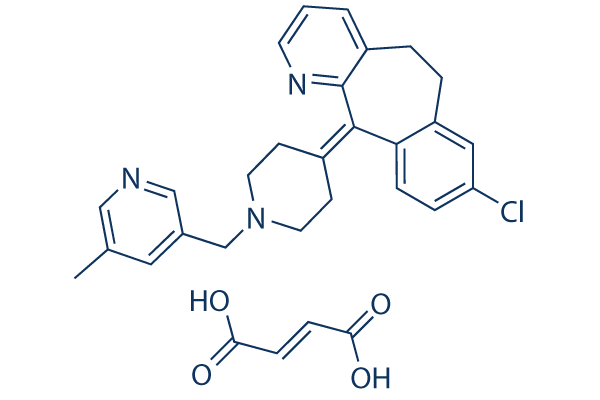
Chemische Struktur
Molekulargewicht: 532.03
Qualitätskontrolle
- In Nature Medicine für seine erstklassige Qualität zitiert
- COA
- NMR
- HPLC
- SDS
- Datenblatt
| Verwandte Ziele | Adrenergic Receptor AChR 5-HT Receptor COX Calcium Channel Dopamine Receptor GABA Receptor TRP Channel Cholinesterase (ChE) GluR |
|---|---|
| Weitere Histamine Receptor Inhibitoren | GSK2879552 Dihydrochloride JNJ-7777120 Ebastine Ciproxifan Maleate Mianserin HCl Astemizole Lafutidine Mizolastine Betahistine 2HCl Levodropropizine |
Chemische Informationen, Lagerung & Stabilität
| Molekulargewicht | 532.03 | Formel | C26H26ClN3.C4H4O4 |
Lagerung (Ab dem Eingangsdatum) | |
|---|---|---|---|---|---|
| CAS-Nr. | 182349-12-8 | SDF herunterladen | Lagerung von Stammlösungen |
|
|
| Synonyme | N/A | Smiles | CC1=CC(=CN=C1)CN2CCC(=C3C4=C(CCC5=C3N=CC=C5)C=C(C=C4)Cl)CC2.C(=CC(=O)O)C(=O)O | ||
Löslichkeit
|
In vitro |
Ethanol : 13 mg/mL
DMSO
: 9 mg/mL
(16.91 mM)
Water : Insoluble |
Molaritätsrechner
|
In vivo |
|||||
In-vivo-Formulierungsrechner (Klare Lösung)
Schritt 1: Geben Sie die untenstehenden Informationen ein (Empfohlen: Ein zusätzliches Tier zur Berücksichtigung von Verlusten während des Experiments)
Schritt 2: Geben Sie die In-vivo-Formulierung ein (Dies ist nur der Rechner, keine Formulierung. Bitte kontaktieren Sie uns zuerst, wenn es im Abschnitt "Löslichkeit" keine In-vivo-Formulierung gibt.)
Berechnungsergebnisse:
Arbeitskonzentration: mg/ml;
Methode zur Herstellung der DMSO-Stammlösung: mg Wirkstoff vorgelöst in μL DMSO ( Konzentration der Stammlösung mg/mL, Bitte kontaktieren Sie uns zuerst, wenn die Konzentration die DMSO-Löslichkeit der Wirkstoffcharge überschreitet. )
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügenμL PEG300, mischen und klären, dann hinzufügenμL Tween 80, mischen und klären, dann hinzufügen μL ddH2O, mischen und klären.
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügen μL Maisöl, mischen und klären.
Hinweis: 1. Bitte stellen Sie sicher, dass die Flüssigkeit klar ist, bevor Sie das nächste Lösungsmittel hinzufügen.
2. Achten Sie darauf, das/die Lösungsmittel der Reihe nach hinzuzufügen. Sie müssen sicherstellen, dass die bei der vorherigen Zugabe erhaltene Lösung eine klare Lösung ist, bevor Sie mit der Zugabe des nächsten Lösungsmittels fortfahren. Physikalische Methoden wie Vortex, Ultraschall oder ein heißes Wasserbad können zur Unterstützung des Lösens verwendet werden.
Wirkmechanismus
| Targets/IC50/Ki |
Histamine H1 receptor
102 nM(Ki)
PAFR
550 nM(Ki)
|
|---|---|
| In vitro |
Rupatadine hemmt sowohl die Wirkung des Plättchen-aktivierenden Faktors (PAF) als auch des Histamins (H1) durch seine Interaktion mit spezifischen Rezeptoren. Rupatadine hemmt kompetitiv die Histamin-induzierte Kontraktion des Meerschweinchenileums (pA2 = 9,29 ± 0,06), ohne die durch ACh, Serotonin oder Leukotrien D4 (LTD4) induzierte Kontraktion zu beeinflussen. Es hemmt auch kompetitiv die PAF-induzierte Plättchenaggregation in gewaschenen Kaninchenplättchen (WRP) (pA2 = 6,68 ± 0,08) und in humanem plättchenreichem Plasma (HPRP) (IC50 = 0,68 μM), während es die ADP- oder Arachidonsäure-induzierte Plättchenaggregation nicht beeinflusst. In einer anderen Studie wird berichtet, dass Rupatadine und Loratadine eine ähnliche hemmende Wirkung auf die Histamin- und TNF-α-Freisetzung zeigen, während SR-27417A nur eine hemmende Wirkung gegen TNF-α aufweist.
|
| Kinase-Assay |
[3H]-Pyrilamin-Bindung an Histamine (H1) receptor in Meerschweinchen-Kleinhirnmembranen.
|
|
Antagonisten werden mit Meerschweinchen-Kleinhirnmembranen (0,6 mg/ml) und [3H]-Pyrilamin (1,2 nM) in 0,5 ml 50 mM PBS, pH 7,5, für 30 min bei 25 ℃ inkubiert. Die Inkubation wird durch Zugabe von 5 ml eiskaltem PBS, das 2 μM Pyrilamin enthält, und das Sammeln der Membranen auf Whatman GF/B-Filtern beendet. Anschließend werden die Filter mit 3 × 5 ml eiskaltem PBS plus 2 μM Pyrilamin gewaschen und in Zählgläschen überführt. Die von jedem Filter zurückgehaltene Radioaktivität wird durch Flüssigszintillationszählung in 3 ml HiSafe 3 gemessen. Die spezifische Bindung wird aus der Differenz zwischen dem in Abwesenheit und in Anwesenheit eines großen molaren Überschusses (10 μM) von unmarkiertem Promethazin gebundenen [3H]-Pyrilamin bestimmt.
|
|
| In vivo |
Rupatadine blockiert Histamin- und PAF-induzierte Effekte in vivo, wie Hypotonie bei Ratten (ID50 = 1,4 bzw. 0,44 mg/kg i.v.) und Bronchokonstriktion bei Meerschweinchen (ID50 = 113 bzw. 9,6 μg/kg i.v.). Darüber hinaus hemmt es potent die PAF-induzierte Mortalität bei Mäusen (ID50 = 0,31 und 3,0 mg/kg i.v. bzw. p.o.) und die Endotoxin-induzierte Mortalität bei Mäusen und Ratten (ID50 = 1,6 und 0,66 mg/kg i.v.). Die Wirkungsdauer von Rupatadine ist lang, wie durch den Histamin- und PAF-induzierten Anstieg der vaskulären Permeabilität bei Hunden (42 und 34 % Hemmung 26 h nach 1 mg/kg p.o.) belegt wird. Rupatadine in einer Dosis von 100 mg/kg p.o. modifiziert weder die spontane motorische Aktivität noch verlängert es die Barbiturat-Schlafzeit bei Mäusen, was auf das Fehlen sedierender Wirkungen hindeutet.
|
Literatur |
|
Klinische Studieninformationen
(Daten von https://clinicaltrials.gov, aktualisiert am 2024-05-22)
| NCT-Nummer | Rekrutierung | Erkrankungen | Sponsor/Kooperationspartner | Startdatum | Phasen |
|---|---|---|---|---|---|
| NCT01605487 | Completed | Cold Contact Urticaria |
Charite University Berlin Germany|Hospital del Mar |
June 2012 | Phase 2 |
| NCT00199251 | Terminated | Urticaria |
J. Uriach and Company |
April 2004 | Phase 3 |
Technischer Support
Tel: +1-832-582-8158 Ext:3
Wenn Sie weitere Fragen haben, hinterlassen Sie bitte eine Nachricht.
