nur für Forschungszwecke
Glyburide (Glibenclamide) Potassium Channel Inhibitor
Kat.-Nr.S1716
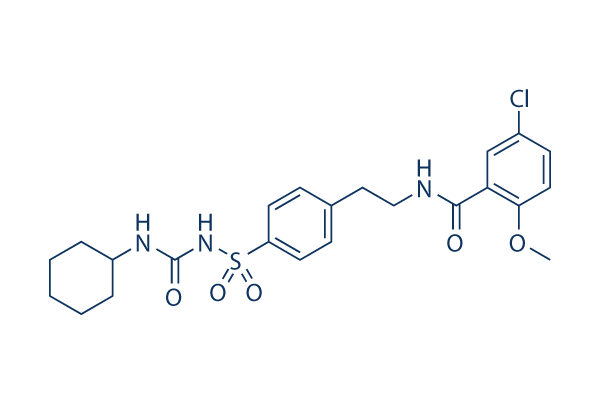
Chemische Struktur
Molekulargewicht: 494
Qualitätskontrolle
| Verwandte Ziele | CFTR CRM1 CD markers AChR Calcium Channel Sodium Channel GABA Receptor TRP Channel ATPase GluR |
|---|---|
| Weitere Potassium Channel Inhibitoren | TRAM-34 Nicorandil ML133 HCl Sophocarpine Hydralazine HCl Nigericin Gliquidone E-4031 dihydrochloride PAP-1 Ajmaline |
Zellkultur, Behandlung & Arbeitskonzentration
| Zelllinien | Assay-Typ | Konzentration | Inkubationszeit | Formulierung | Aktivitätsbeschreibung | PMID |
|---|---|---|---|---|---|---|
| INS-1E cells | Function assay | 1 h | Stimulation of insulin secretion in rat INS-1E cells after 1 hr by alphaLISA assay in presence of 5 mM glucose, EC50=0.003 μM | |||
| CHO cells | Function assay | Inhibition of human SUR1/Kir6.2 expressed in CHO cells, IC50=0.0043 μM | ||||
| HEK293 cells | Function assay | Inhibition of OATP1B1 (unknown origin) expressed in HEK293 cells using estradiol-17beta-glucuronide substrate, IC50=1.4 μM | ||||
| Klicken Sie hier, um weitere experimentelle Daten zu Zelllinien anzuzeigen | ||||||
Chemische Informationen, Lagerung & Stabilität
| Molekulargewicht | 494 | Formel | C23H28ClN3O5S |
Lagerung (Ab dem Eingangsdatum) | |
|---|---|---|---|---|---|
| CAS-Nr. | 10238-21-8 | SDF herunterladen | Lagerung von Stammlösungen |
|
|
| Synonyme | Glibenclamide | Smiles | COC1=C(C=C(C=C1)Cl)C(=O)NCCC2=CC=C(C=C2)S(=O)(=O)NC(=O)NC3CCCCC3 | ||
Löslichkeit
|
In vitro |
DMSO
: 99 mg/mL
(200.4 mM)
Water : Insoluble Ethanol : Insoluble |
Molaritätsrechner
|
In vivo |
|||||
In-vivo-Formulierungsrechner (Klare Lösung)
Schritt 1: Geben Sie die untenstehenden Informationen ein (Empfohlen: Ein zusätzliches Tier zur Berücksichtigung von Verlusten während des Experiments)
Schritt 2: Geben Sie die In-vivo-Formulierung ein (Dies ist nur der Rechner, keine Formulierung. Bitte kontaktieren Sie uns zuerst, wenn es im Abschnitt "Löslichkeit" keine In-vivo-Formulierung gibt.)
Berechnungsergebnisse:
Arbeitskonzentration: mg/ml;
Methode zur Herstellung der DMSO-Stammlösung: mg Wirkstoff vorgelöst in μL DMSO ( Konzentration der Stammlösung mg/mL, Bitte kontaktieren Sie uns zuerst, wenn die Konzentration die DMSO-Löslichkeit der Wirkstoffcharge überschreitet. )
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügenμL PEG300, mischen und klären, dann hinzufügenμL Tween 80, mischen und klären, dann hinzufügen μL ddH2O, mischen und klären.
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügen μL Maisöl, mischen und klären.
Hinweis: 1. Bitte stellen Sie sicher, dass die Flüssigkeit klar ist, bevor Sie das nächste Lösungsmittel hinzufügen.
2. Achten Sie darauf, das/die Lösungsmittel der Reihe nach hinzuzufügen. Sie müssen sicherstellen, dass die bei der vorherigen Zugabe erhaltene Lösung eine klare Lösung ist, bevor Sie mit der Zugabe des nächsten Lösungsmittels fortfahren. Physikalische Methoden wie Vortex, Ultraschall oder ein heißes Wasserbad können zur Unterstützung des Lösens verwendet werden.
Wirkmechanismus
| Targets/IC50/Ki |
Potassium channel
|
|---|---|
| In vitro |
Glyburide (Glibenclamide), ein Sulfonylharnstoff, der den ATP-modulierten Kaliumkanal in insulinsezernierenden Zellen blockiert, verursacht konzentrationsabhängige Rechtsverschiebungen (bis zu 100-fach) des IC50-Wertes für BRL 34915 und Diazoxid und hebt bei 1 μM die Entspannungsreaktion auf Minoxidilsulfat auf. Diese Verbindung erhöht die scheinbare Affinität der HDL-Bindung an den Scavenger-Rezeptor Klasse B Typ I (SR-BI). Sie blockiert die SR-BI-vermittelte selektive Lipidaufnahme und -abgabe mit einer ähnlichen Potenz wie bei der Hemmung von ABCA1 (IC50 ca. 275-300 mM). Bei 6 mM reduziert es die Öffnung von KATP-Kanälen und verschlimmert die Ca2+-Beladung nur, wenn es auf Dinitrophenol-vorbehandelte Myozyten angewendet wird, nicht aber, wenn es gleichzeitig mit Dinitrophenol angewendet wird. In Konzentrationen von 10-500 nM bewirkt es eine dosisabhängige Hemmung des Entspannungszeitverlaufs der Kaliumkanalöffner (PCOs). Es kehrt auch die bestehende Pinacidil-Entspannung um, unabhängig vom Grad der bereits vorhandenen Entspannung, und ist in der Lage, seine Blockade unabhängig vom Zustand der K+-Kanalaktivierung zu bewirken.
|
| In vivo |
S1716 erhöht die Urin-Na+-Ausscheidung dosisabhängig mit geringer Veränderung der Urin-K+-Ausscheidung nach i.p.-Verabreichung (10-100 mg/kg) bei salzbeladenen wachen Ratten. S1716 (25 mg/kg i.v.) erhöht die Na+-Ausscheidung um 350% während der ersten Stunde nach der Behandlung, ohne die K+-Ausscheidung, die glomeruläre Filtrationsrate, den mittleren arteriellen Druck oder die Herzfrequenz zu beeinflussen.
|
Literatur |
|
Klinische Studieninformationen
(Daten von https://clinicaltrials.gov, aktualisiert am 2024-05-22)
| NCT-Nummer | Rekrutierung | Erkrankungen | Sponsor/Kooperationspartner | Startdatum | Phasen |
|---|---|---|---|---|---|
| NCT05426681 | Recruiting | Acute Spinal Cord Injury |
University of Kentucky |
July 7 2022 | Phase 1 |
| NCT03832595 | Completed | Chronic Kidney Diseases |
University of Pittsburgh|Vanderbilt University Medical Center|National Institute of Diabetes and Digestive and Kidney Diseases (NIDDK) |
May 1 2019 | Not Applicable |
Technischer Support
Tel: +1-832-582-8158 Ext:3
Wenn Sie weitere Fragen haben, hinterlassen Sie bitte eine Nachricht.
