nur für Forschungszwecke
pomaglumetad (LY404039) GluR Agonist
Kat.-Nr.S6001
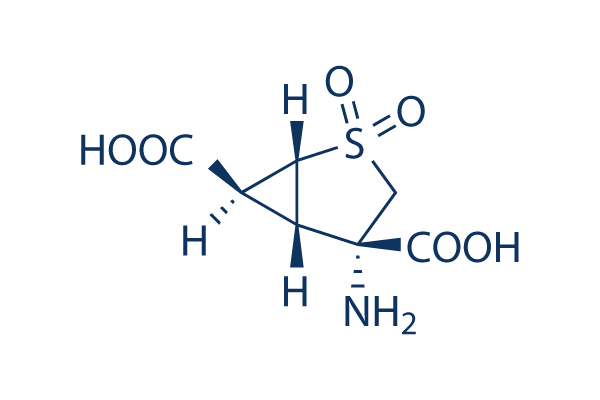
Chemische Struktur
Molekulargewicht: 235.22
Qualitätskontrolle
Chemische Informationen, Lagerung & Stabilität
| Molekulargewicht | 235.22 | Formel | C7H9NO6S |
Lagerung (Ab dem Eingangsdatum) | |
|---|---|---|---|---|---|
| CAS-Nr. | 635318-11-5 | SDF herunterladen | Lagerung von Stammlösungen |
|
|
| Synonyme | N/A | Smiles | C1C(C2C(C2S1(=O)=O)C(=O)O)(C(=O)O)N | ||
Löslichkeit
|
In vitro |
5%TFA : 3.06 mg/mL
DMSO
: 0.5 mg/mL
(2.12 mM)
Water : Insoluble |
Molaritätsrechner
|
In vivo |
|||||
In-vivo-Formulierungsrechner (Klare Lösung)
Schritt 1: Geben Sie die untenstehenden Informationen ein (Empfohlen: Ein zusätzliches Tier zur Berücksichtigung von Verlusten während des Experiments)
Schritt 2: Geben Sie die In-vivo-Formulierung ein (Dies ist nur der Rechner, keine Formulierung. Bitte kontaktieren Sie uns zuerst, wenn es im Abschnitt "Löslichkeit" keine In-vivo-Formulierung gibt.)
Berechnungsergebnisse:
Arbeitskonzentration: mg/ml;
Methode zur Herstellung der DMSO-Stammlösung: mg Wirkstoff vorgelöst in μL DMSO ( Konzentration der Stammlösung mg/mL, Bitte kontaktieren Sie uns zuerst, wenn die Konzentration die DMSO-Löslichkeit der Wirkstoffcharge überschreitet. )
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügenμL PEG300, mischen und klären, dann hinzufügenμL Tween 80, mischen und klären, dann hinzufügen μL ddH2O, mischen und klären.
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügen μL Maisöl, mischen und klären.
Hinweis: 1. Bitte stellen Sie sicher, dass die Flüssigkeit klar ist, bevor Sie das nächste Lösungsmittel hinzufügen.
2. Achten Sie darauf, das/die Lösungsmittel der Reihe nach hinzuzufügen. Sie müssen sicherstellen, dass die bei der vorherigen Zugabe erhaltene Lösung eine klare Lösung ist, bevor Sie mit der Zugabe des nächsten Lösungsmittels fortfahren. Physikalische Methoden wie Vortex, Ultraschall oder ein heißes Wasserbad können zur Unterstützung des Lösens verwendet werden.
Wirkmechanismus
| Merkmale |
Under investigation as an exciting new medicine that may herald the arrival of third-generation antipsychotic drugs.
|
|---|---|
| Targets/IC50/Ki |
Rat neurons expressing native mGlu2/3
88 nM(Ki)
Recombinant human mGlu3
92 nM(Ki)
Recombinant human mGlu2
149 nM(Ki)
|
| In vitro |
pomaglumetad (LY404039) zeigt eine geringe Bindungsaffinität zu mGlu-Rezeptoren der Gruppe III, einschließlich mGlu6, mGlu7 und mGlu8, mit einem Ki-Wert von mehr als 5 μM und zeigt eine geringe Affinität zu ionotropen Glutamatrezeptoren, Glutamattransporter-Subtypen, Monoaminen und anderen Rezeptoren. Es hemmt potent die Forskolin-stimulierte cAMP-Bildung in Zellen, die menschliche mGlu2- und mGlu3-Rezeptoren exprimieren. Diese Verbindung unterdrückt die elektrisch ausgelöste exzitatorische Aktivität im Striatum und die Serotonin-induzierte L-Glutamat-Freisetzung im präfrontalen Kortex. Es könnte die glutamaterge Aktivität in limbischen und Vorderhirnbereichen modulieren, die für psychiatrische Erkrankungen relevant sind, und möglicherweise frei von negativen Nebenwirkungen sein, die mit aktuellen Antipsychotika und Anxiolytika verbunden sind.
|
| In vivo |
pomaglumetad (LY404039) zeigt eine höhere Plasmaexposition und bessere orale Bioverfügbarkeit und könnte bei der Behandlung neuropsychiatrischer Störungen, einschließlich Angstzuständen und Psychosen, wertvoll sein. Bei Wildtyp-Tieren kehrt diese Verbindung den d-Amphetamin(AMP)-induzierten Anstieg der Ambulationen, der zurückgelegten Strecke und der reduzierten Ruhezeit signifikant um. Es kehrt die Phencyclidin (PCP)-induzierten Verhaltensweisen bei 10 mg/kg um. Die antipsychotischen Effekte von LY404039 auf PCP- und AMP-induzierte Verhaltensaktivierung fehlen bei mGlu2- und mGlu2/3-, aber nicht bei mGlu3-Rezeptor-defizienten Mäusen. Im Gegensatz dazu hemmen Clozapin und Risperidon PCP-induzierte Verhaltensweisen sowohl bei Wildtyp- als auch bei mGlu2/3-Rezeptor-defizienten Mäusen. Es reduziert das Ansprechen auf EtOH im Pavlovian Spontaneous Recovery (PSR)-Test und reduziert die Expression eines Alkoholentzugseffekts (ADE) während des Rückfalls, beeinflusst jedoch nicht das EtOH-Ansprechen unter Wartungsbedingungen. Diese Verbindung hemmt die Expression von Alkoholsuch- und Rückfallverhalten, ohne das Alkohol-Selbstverabreichungsverhalten zu verändern. Darüber hinaus dämpft es Amphetamin- und Phencyclidin-induzierte Hyperlokomotion. Es könnte die konditionierte Vermeidungsreaktion hemmen und reduziert auch die angstverstärkte Schreckreaktion bei Ratten und das Vergraben von Murmeln bei Mäusen. Wichtig ist, dass es keine sedierenden Effekte oder motorische Beeinträchtigungen bei der konditionierten Vermeidungsaufgabe hervorruft. Es erhöht auch die Dopamin- und Serotoninfreisetzung/-umsatz im präfrontalen Kortex.
|
Literatur |
|
Klinische Studieninformationen
(Daten von https://clinicaltrials.gov, aktualisiert am 2024-05-22)
| NCT-Nummer | Rekrutierung | Erkrankungen | Sponsor/Kooperationspartner | Startdatum | Phasen |
|---|---|---|---|---|---|
| NCT01659177 | Withdrawn | Healthy Participants |
Denovo Biopharma LLC |
August 2012 | Phase 1 |
| NCT01637142 | Completed | Healthy Participants |
Denovo Biopharma LLC |
July 2012 | Phase 1 |
| NCT01609218 | Completed | Healthy Volunteer Study |
Denovo Biopharma LLC |
June 2012 | Phase 1 |
| NCT01475136 | Completed | Hepatic Insufficiency |
Denovo Biopharma LLC |
November 2011 | Phase 1 |
Technischer Support
Tel: +1-832-582-8158 Ext:3
Wenn Sie weitere Fragen haben, hinterlassen Sie bitte eine Nachricht.
