nur für Forschungszwecke
PluriSIn #1 (NSC 14613) SCD Inhibitor
Kat.-Nr.S8076
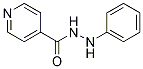
Chemische Struktur
Molekulargewicht: 213.24
Qualitätskontrolle
- In Nature Medicine für seine erstklassige Qualität zitiert
- COA
- NMR
- HPLC
- SDS
- Datenblatt
| Verwandte Ziele | Dehydrogenase HSP Transferase P450 (e.g. CYP17) PDE phosphatase PPAR Vitamin Carbohydrate Metabolism Mitochondrial Metabolism |
|---|---|
| Weitere SCD Inhibitoren | MK-8245 A939572 MF-438 CVT-11127 Aramchol CAY10566 |
Chemische Informationen, Lagerung & Stabilität
| Molekulargewicht | 213.24 | Formel | C12H11N3O |
Lagerung (Ab dem Eingangsdatum) | |
|---|---|---|---|---|---|
| CAS-Nr. | 91396-88-2 | SDF herunterladen | Lagerung von Stammlösungen |
|
|
| Synonyme | N/A | Smiles | C1=CC=C(C=C1)NNC(=O)C2=CC=NC=C2 | ||
Löslichkeit
|
In vitro |
DMSO
: 43 mg/mL
(201.65 mM)
Water : Insoluble Ethanol : Insoluble |
Molaritätsrechner
|
In vivo |
|||||
In-vivo-Formulierungsrechner (Klare Lösung)
Schritt 1: Geben Sie die untenstehenden Informationen ein (Empfohlen: Ein zusätzliches Tier zur Berücksichtigung von Verlusten während des Experiments)
Schritt 2: Geben Sie die In-vivo-Formulierung ein (Dies ist nur der Rechner, keine Formulierung. Bitte kontaktieren Sie uns zuerst, wenn es im Abschnitt "Löslichkeit" keine In-vivo-Formulierung gibt.)
Berechnungsergebnisse:
Arbeitskonzentration: mg/ml;
Methode zur Herstellung der DMSO-Stammlösung: mg Wirkstoff vorgelöst in μL DMSO ( Konzentration der Stammlösung mg/mL, Bitte kontaktieren Sie uns zuerst, wenn die Konzentration die DMSO-Löslichkeit der Wirkstoffcharge überschreitet. )
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügenμL PEG300, mischen und klären, dann hinzufügenμL Tween 80, mischen und klären, dann hinzufügen μL ddH2O, mischen und klären.
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügen μL Maisöl, mischen und klären.
Hinweis: 1. Bitte stellen Sie sicher, dass die Flüssigkeit klar ist, bevor Sie das nächste Lösungsmittel hinzufügen.
2. Achten Sie darauf, das/die Lösungsmittel der Reihe nach hinzuzufügen. Sie müssen sicherstellen, dass die bei der vorherigen Zugabe erhaltene Lösung eine klare Lösung ist, bevor Sie mit der Zugabe des nächsten Lösungsmittels fortfahren. Physikalische Methoden wie Vortex, Ultraschall oder ein heißes Wasserbad können zur Unterstützung des Lösens verwendet werden.
Wirkmechanismus
| Targets/IC50/Ki |
SCD1
|
|---|---|
| In vitro |
PluriSIn #1 (NSC 14613) hat eine robuste, schnelle und selektive zytotoxische Wirkung auf hPSCs, wobei Apoptose der zentrale Zellsterbemechanismus ist, den es aktiviert. Diese Verbindung führt zu ER-Stress in hPSCs, wodurch die Proteinsynthese bei 20 μM um ca. 30 % abnimmt. Sie verursacht auch eine Abnahme der Stearoyl-CoA-Desaturase (SCD1)-Aktivität um ca. 65 % und verhindert die Teratombildung aus undifferenzierten hPSCs. PluriSIns hemmt auch mPSCs und behindert die embryonale Entwicklung der Maus.
|
| Kinase-Assay |
SCD1-Aktivitätsassays
|
|
Zellen werden in 6-Well-Platten mit einer Dichte von 50.000 bis 100.000 Zellen pro Well ausgesät. 24 Stunden später werden den Zellen 20 μM PluriSIn #1 (NSC 14613) oder 0,2 % DMSO-Kontrolle zugesetzt. Nach 12 Stunden Inkubation bei 37 ℃, 5 % CO2 wird das alte Medium entfernt, die Zellen mit PBS gewaschen und neues Medium mit 2,3 μM von 0,75 UCi [1-14C] Stearinsäure hinzugefügt. Die Zellen werden bis zu 4 Stunden bei 37 ℃, 5 % CO2 inkubiert. Nach der Inkubationszeit wird das Medium verworfen und die Zellen 3-mal mit 2 ml PBS gewaschen. 2 ml der Mischung n-Hexan: Isopropanol (3:2 v:v) werden hinzugefügt und die Zellen 30 min bei 37 ℃, 5 % CO2 inkubiert. Anschließend werden 2 ml Folch-Lösung (Chloroform: Methanol, 2:1, v:v) hinzugefügt. Die Flüssigkeit wird zur Phasentrennung durch Zugabe von 1 ml Wasser in Röhrchen überführt. Die untere organische Phase wird verdampft und zur Liphidsaponifizierung und TLC-Trennung der freien [1-14C] Stearinsäure (Substrat) und [1-14C] Ölsäure (gebildetes Produkt) verwendet. Aus den Zellen extrahierte Lipide werden auf TLC-Platten aufgetragen, die zuvor in 10 % NO3 Ag getaucht und bei 120℃x60 min aktiviert wurden. Unmarkierte Stearin- und Ölsäure werden jedem Auftragspunkt als Träger und als interne Standards zur Identifizierung hinzugefügt. Die Platten werden mit einer Lösungsmittelmischung aus Chloroform:MeOH:AcH:DDW (90:8:1:0.8) entwickelt. Die freien Fettsäuren werden nach Besprühen der TLC mit einer 2',7',Dichlorofluorescein-Lösung mittels U.V. detektiert. Die den Stearin- und Ölsäuren entsprechenden Flecken werden abgekratzt und die Radioaktivität in einem Szintillationszähler gezählt. Die SCD1-Desaturase-Aktivität wird aus der prozentualen Umwandlung von Substrat zu Produkt und der Umwandlung in pmol/min/106 Zellen berechnet.
|
Literatur |
Technischer Support
Tel: +1-832-582-8158 Ext:3
Wenn Sie weitere Fragen haben, hinterlassen Sie bitte eine Nachricht.
