nur für Forschungszwecke
ABX-1431 Lipase Hemmer
Kat.-Nr.S8823
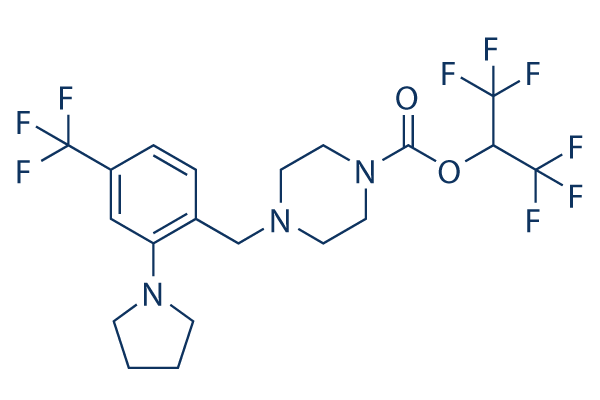
Chemische Struktur
Molekulargewicht: 507.39
Qualitätskontrolle
- In Nature Medicine für seine erstklassige Qualität zitiert
- COA
- NMR
- SDS
- Datenblatt
| Verwandte Ziele | Dehydrogenase HSP Transferase P450 (e.g. CYP17) PDE phosphatase PPAR Vitamin Carbohydrate Metabolism Mitochondrial Metabolism |
|---|---|
| Weitere Lipase Inhibitoren | Tanshinone IIA Atglistatin JZL184 Pristimerin XEN445 Cetilistat Pancreatin Schaftoside URB602 Ibrolipim |
Chemische Informationen, Lagerung & Stabilität
| Molekulargewicht | 507.39 | Formel | C20H22F9N3O2 |
Lagerung (Ab dem Eingangsdatum) | 3 years -20°C powder |
|---|---|---|---|---|---|
| CAS-Nr. | 1446817-84-0 | -- | Lagerung von Stammlösungen |
|
|
| Synonyme | N/A | Smiles | C1CCN(C1)C2=C(C=CC(=C2)C(F)(F)F)CN3CCN(CC3)C(=O)OC(C(F)(F)F)C(F)(F)F | ||
Löslichkeit
|
In vitro |
DMSO
: 100 mg/mL
(197.08 mM)
Ethanol : 100 mg/mL Water : Insoluble |
Molaritätsrechner
|
In vivo |
|||||
In-vivo-Formulierungsrechner (Klare Lösung)
Schritt 1: Geben Sie die untenstehenden Informationen ein (Empfohlen: Ein zusätzliches Tier zur Berücksichtigung von Verlusten während des Experiments)
Schritt 2: Geben Sie die In-vivo-Formulierung ein (Dies ist nur der Rechner, keine Formulierung. Bitte kontaktieren Sie uns zuerst, wenn es im Abschnitt "Löslichkeit" keine In-vivo-Formulierung gibt.)
Berechnungsergebnisse:
Arbeitskonzentration: mg/ml;
Methode zur Herstellung der DMSO-Stammlösung: mg Wirkstoff vorgelöst in μL DMSO ( Konzentration der Stammlösung mg/mL, Bitte kontaktieren Sie uns zuerst, wenn die Konzentration die DMSO-Löslichkeit der Wirkstoffcharge überschreitet. )
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügenμL PEG300, mischen und klären, dann hinzufügenμL Tween 80, mischen und klären, dann hinzufügen μL ddH2O, mischen und klären.
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügen μL Maisöl, mischen und klären.
Hinweis: 1. Bitte stellen Sie sicher, dass die Flüssigkeit klar ist, bevor Sie das nächste Lösungsmittel hinzufügen.
2. Achten Sie darauf, das/die Lösungsmittel der Reihe nach hinzuzufügen. Sie müssen sicherstellen, dass die bei der vorherigen Zugabe erhaltene Lösung eine klare Lösung ist, bevor Sie mit der Zugabe des nächsten Lösungsmittels fortfahren. Physikalische Methoden wie Vortex, Ultraschall oder ein heißes Wasserbad können zur Unterstützung des Lösens verwendet werden.
Wirkmechanismus
| Targets/IC50/Ki |
hMGLL
14 nM
mMGLL
27 nM
|
|---|---|
| In vitro |
ABX-1431 ist ein potenter humaner MGLL-Inhibitor (durchschnittlicher IC50 = 0,014 μM) mit einer über 100-fachen Selektivität gegenüber ABHD6 und einer über 200-fachen Selektivität gegenüber PLA2G7. Die Behandlung intakter humaner PC3-Zellen mit dieser Verbindung nach einer 30-minütigen Inkubationszeit des Inhibitors führt zu einer konzentrationsabhängigen Hemmung der MGLL-Aktivität mit einem IC50-Wert von 0,0022 μM, was etwa 6-mal potenter ist als die in vitro beobachtete. Diese Chemikalie hemmt MGLL durch Carbamoylierung des katalytischen Nukleophils Ser122. |
| In vivo |
Pharmakokinetische Analysen von ABX-1431 bei Ratten und Hunden zeigen eine geringe bis moderate systemische Clearance, ein moderates Verteilungsvolumen und eine hohe orale Bioverfügbarkeit (64 % bei Ratten, 57 % bei Hunden). Während diese Verbindung in humanem und Hundeplasma stabil ist, ist sie in Rattenplasma nicht stabil. Diese Chemikalie ist ein potenter und selektiver Inhibitor von MGLL im Maus- und Rattenhirn in vivo. Sie hemmt die MGLL-Aktivität mit einem ED50 von 0,5-1,4 mg/kg (po) und erhöht dosisabhängig die 2-AG-Spiegel im Mausgehirn. Ein entzündliches Schmerzmodell an Ratten wird zur Beurteilung der pharmakodynamischen Wirkung verwendet. Die Verbindung zeigt potente antinozizeptive Wirkungen in einem Formalin-Pfoten-Test bei einer Dosis, die eine nahezu vollständige MGLL-Hemmung und maximale Erhöhung von 2-AG hervorrief. |
Literatur |
|
Klinische Studieninformationen
(Daten von https://clinicaltrials.gov, aktualisiert am 2024-05-22)
| NCT-Nummer | Rekrutierung | Erkrankungen | Sponsor/Kooperationspartner | Startdatum | Phasen |
|---|---|---|---|---|---|
| NCT03447756 | Completed | Post Herpetic Neuralgia|Diabetic Peripheral Neuropathy|Small Fiber Neuropathy|Post-Traumatic Neuralgia |
Abide Therapeutics |
October 2 2017 | Phase 1 |
| NCT03138421 | Completed | Neuromyelitis Optica Spectrum Disorder|Transverse Myelitis|Multiple Sclerosis|Longitudinally Extensive Transverse Myelitis |
Abide Therapeutics |
August 1 2017 | Phase 1 |
| NCT03058562 | Completed | Tourette Syndrome|Chronic Motor Tic Disorder |
Abide Therapeutics |
February 1 2017 | Phase 1 |
| NCT02929264 | Completed | Pain |
Abide Therapeutics|University of Oxford |
December 2016 | Phase 1 |
Technischer Support
Tel: +1-832-582-8158 Ext:3
Wenn Sie weitere Fragen haben, hinterlassen Sie bitte eine Nachricht.
