nur für Forschungszwecke
Boceprevir HCV Protease Inhibitor
Kat.-Nr.S3733
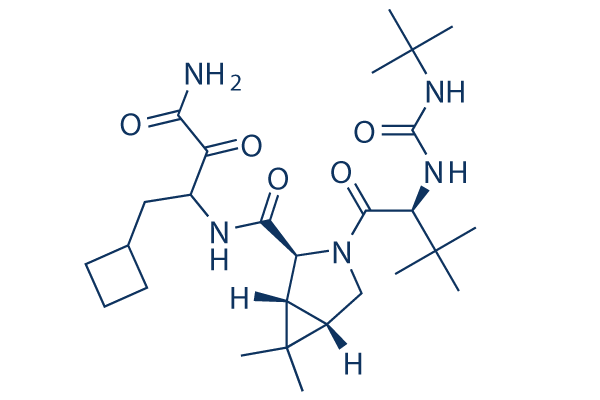
Chemische Struktur
Molekulargewicht: 519.68
Qualitätskontrolle
- Zitiert in Nature Medicine für seine erstklassige Qualität
- COA
- NMR
- Datenblatt
- SDS
- Zitiert in Nature Medicine für seine erstklassige Qualität
- COA
- NMR
- Datenblatt
- SDS
| Verwandte Ziele | HDAC Caspase Proteasome Secretase MMP Cysteine Protease DPP Tyrosinase HIV Protease Serine Protease |
|---|---|
| Weitere HCV Protease Inhibitoren | Danoprevir Lomibuvir (VX-222) Asunaprevir Tizoxanide PSI-6206 (GS-331007) Mecarbinate Tegobuvir Herba taxilli Extract 2'-C-Methylcytidine |
Chemische Informationen, Lagerung & Stabilität
| Molekulargewicht | 519.68 | Formel | C27H45N5O5 |
Lagerung (Ab dem Eingangsdatum) | |
|---|---|---|---|---|---|
| CAS-Nr. | 394730-60-0 | SDF herunterladen | Lagerung von Stammlösungen |
|
|
| Synonyme | EBP 520, SCH 503034 | Smiles | CC1(C2C1C(N(C2)C(=O)C(C(C)(C)C)NC(=O)NC(C)(C)C)C(=O)NC(CC3CCC3)C(=O)C(=O)N)C | ||
Löslichkeit
|
In vitro |
DMSO
: 100 mg/mL
(192.42 mM)
Ethanol : 100 mg/mL Water : Insoluble |
Molaritätsrechner
|
In vivo |
|||||
In-vivo-Formulierungsrechner (Klare Lösung)
Schritt 1: Geben Sie die untenstehenden Informationen ein (Empfohlen: Ein zusätzliches Tier zur Berücksichtigung von Verlusten während des Experiments)
Schritt 2: Geben Sie die In-vivo-Formulierung ein (Dies ist nur der Rechner, keine Formulierung. Bitte kontaktieren Sie uns zuerst, wenn es im Abschnitt "Löslichkeit" keine In-vivo-Formulierung gibt.)
Berechnungsergebnisse:
Arbeitskonzentration: mg/ml;
Methode zur Herstellung der DMSO-Stammlösung: mg Wirkstoff vorgelöst in μL DMSO ( Konzentration der Stammlösung mg/mL, Bitte kontaktieren Sie uns zuerst, wenn die Konzentration die DMSO-Löslichkeit der Wirkstoffcharge überschreitet. )
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügenμL PEG300, mischen und klären, dann hinzufügenμL Tween 80, mischen und klären, dann hinzufügen μL ddH2O, mischen und klären.
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügen μL Maisöl, mischen und klären.
Hinweis: 1. Bitte stellen Sie sicher, dass die Flüssigkeit klar ist, bevor Sie das nächste Lösungsmittel hinzufügen.
2. Achten Sie darauf, das/die Lösungsmittel der Reihe nach hinzuzufügen. Sie müssen sicherstellen, dass die bei der vorherigen Zugabe erhaltene Lösung eine klare Lösung ist, bevor Sie mit der Zugabe des nächsten Lösungsmittels fortfahren. Physikalische Methoden wie Vortex, Ultraschall oder ein heißes Wasserbad können zur Unterstützung des Lösens verwendet werden.
Wirkmechanismus
| Targets/IC50/Ki |
NS3/4A protease
14 nM(Ki)
|
|---|---|
| In vitro |
Die Behandlung mit NLRP3 Inflammasom-Inhibitor I begrenzt die IL-1β-Freisetzung nach LPS- und ATP-Stimulation erheblich. NLRP3 Inflammasom-Inhibitor I ist kein Caspase-1-Inhibitor.
|
| In vivo |
Das kleine Molekül NLRP3 Inflammasom-Inhibitor I, ein Zwischensubstrat bei der Glyburid-Synthese ohne die Cyclohexylharnstoff-Einheit, hemmt die Bildung des NLRP3-Inflammasoms in Kardiomyozyten und begrenzt die Infarktgröße nach myokardialer Ischämie/Reperfusion bei Mäusen, ohne den Glukosestoffwechsel zu beeinflussen.
|
Literatur |
Klinische Studieninformationen
(Daten von https://clinicaltrials.gov, aktualisiert am 2024-05-22)
| NCT-Nummer | Rekrutierung | Erkrankungen | Sponsor/Kooperationspartner | Startdatum | Phasen |
|---|---|---|---|---|---|
| NCT01909401 | Completed | Liver Transplantation |
Indiana University|Merck Sharp & Dohme LLC |
June 2013 | Early Phase 1 |
| NCT01821625 | Terminated | Thrombocytopenia|Hepatitis C |
University of Texas Southwestern Medical Center|GlaxoSmithKline |
April 2013 | Phase 2|Phase 3 |
| NCT01499498 | Completed | Hepatitis C |
Imperial College London |
December 2012 | Phase 1 |
| NCT01663922 | Completed | Hepatitis C |
St Stephens Aids Trust|University of Liverpool|University of Turin Italy |
August 2012 | Phase 1 |
| NCT01657552 | Completed | Thrombocytopaenia |
GlaxoSmithKline |
August 1 2012 | Phase 1 |
Technischer Support
Tel: +1-832-582-8158 Ext:3
Wenn Sie weitere Fragen haben, hinterlassen Sie bitte eine Nachricht.
