nur für Forschungszwecke
Paritaprevir (ABT-450) HCV Protease Inhibitor
Kat.-Nr.S5404
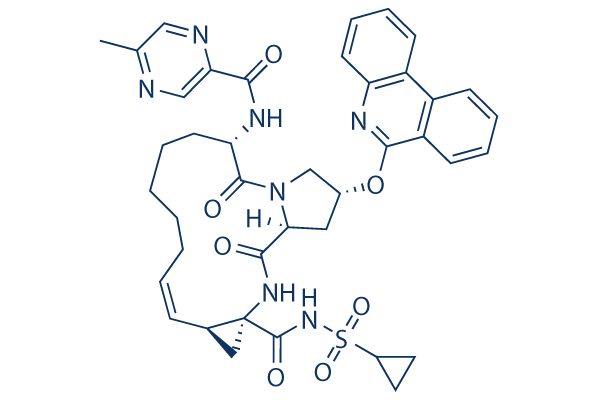
Chemische Struktur
Molekulargewicht: 765.88
Qualitätskontrolle
- In Nature Medicine für seine erstklassige Qualität zitiert
- COA
- SDS
- Datenblatt
| Verwandte Ziele | HDAC Caspase Proteasome Secretase MMP Cysteine Protease DPP Tyrosinase HIV Protease Serine Protease |
|---|---|
| Weitere HCV Protease Inhibitoren | Danoprevir Lomibuvir (VX-222) Asunaprevir Tizoxanide PSI-6206 (GS-331007) Mecarbinate Tegobuvir Herba taxilli Extract 2'-C-Methylcytidine |
Chemische Informationen, Lagerung & Stabilität
| Molekulargewicht | 765.88 | Formel | C40H43N7O7S |
Lagerung (Ab dem Eingangsdatum) | |
|---|---|---|---|---|---|
| CAS-Nr. | 1216941-48-8 | -- | Lagerung von Stammlösungen |
|
|
| Synonyme | N/A | Smiles | CC1=CN=C(C=N1)C(=O)NC2CCCCCC=CC3CC3(NC(=O)C4CC(CN4C2=O)OC5=NC6=CC=CC=C6C7=CC=CC=C75)C(=O)NS(=O)(=O)C8CC8 | ||
Löslichkeit
|
In vitro |
DMSO
: 100 mg/mL
(130.56 mM)
|
Molaritätsrechner
|
In vivo |
|||||
In-vivo-Formulierungsrechner (Klare Lösung)
Schritt 1: Geben Sie die untenstehenden Informationen ein (Empfohlen: Ein zusätzliches Tier zur Berücksichtigung von Verlusten während des Experiments)
Schritt 2: Geben Sie die In-vivo-Formulierung ein (Dies ist nur der Rechner, keine Formulierung. Bitte kontaktieren Sie uns zuerst, wenn es im Abschnitt "Löslichkeit" keine In-vivo-Formulierung gibt.)
Berechnungsergebnisse:
Arbeitskonzentration: mg/ml;
Methode zur Herstellung der DMSO-Stammlösung: mg Wirkstoff vorgelöst in μL DMSO ( Konzentration der Stammlösung mg/mL, Bitte kontaktieren Sie uns zuerst, wenn die Konzentration die DMSO-Löslichkeit der Wirkstoffcharge überschreitet. )
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügenμL PEG300, mischen und klären, dann hinzufügenμL Tween 80, mischen und klären, dann hinzufügen μL ddH2O, mischen und klären.
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügen μL Maisöl, mischen und klären.
Hinweis: 1. Bitte stellen Sie sicher, dass die Flüssigkeit klar ist, bevor Sie das nächste Lösungsmittel hinzufügen.
2. Achten Sie darauf, das/die Lösungsmittel der Reihe nach hinzuzufügen. Sie müssen sicherstellen, dass die bei der vorherigen Zugabe erhaltene Lösung eine klare Lösung ist, bevor Sie mit der Zugabe des nächsten Lösungsmittels fortfahren. Physikalische Methoden wie Vortex, Ultraschall oder ein heißes Wasserbad können zur Unterstützung des Lösens verwendet werden.
Wirkmechanismus
| Targets/IC50/Ki |
HCV genotype 1b
(in replicon cell culture assays) 0.21 nM(EC50)
HCV genotype 1a
(in replicon cell culture assays) 1 nM(EC50)
|
|---|---|
| In vitro |
Paritaprevir (ABT-450) hemmt p-Glykoprotein (p-gp) in vitro. Es ist ein wirksamer Inhibitor der HCV NS3/4A Protease mit 50 % effektiven Konzentrationswerten von 1,0, 0,21, 5,3, 19, 0,09 und 0,69 nM gegen stabile HCV-Replikons mit NS3-Protease der Genotypen 1a, 1b, 2a, 3a, 4a bzw. 6a. Die CC50 dieser Verbindung beträgt mehr als 37 μM, was zu einem In-vitro-Selektivitätsindex von ≥37.000-fach führt. Es zeigt auch Aktivität über mehrere HCV-Genotypen hinweg, mit einer EC50 von 5,3 nM gegen das subgenomische Replikon des Genotyps 2a JFH-1.
|
| In vivo |
Nach oraler Verabreichung erreicht Paritaprevir (ABT-450) maximale Konzentrationen im Mittel nach 4–5 h, wobei die Exposition dosisproportionaler ansteigt. Die absolute Bioverfügbarkeit beträgt etwa 50 % nach Verabreichung mit Nahrung. Es weist eine hohe (etwa 97–99,9 %) Plasmaproteinbindung auf und hat ein scheinbares Verteilungsvolumen von 16,7 L. Der Metabolismus erfolgt über CYP3A4 (überwiegend) und CYP3A5.
|
Literatur |
|
Klinische Studieninformationen
(Daten von https://clinicaltrials.gov, aktualisiert am 2024-05-22)
| NCT-Nummer | Rekrutierung | Erkrankungen | Sponsor/Kooperationspartner | Startdatum | Phasen |
|---|---|---|---|---|---|
| NCT02581020 | Completed | Hepatitis C Virus |
AbbVie |
January 14 2016 | -- |
| NCT02534870 | Completed | Healthy Volunteer |
AbbVie |
September 2015 | Phase 1 |
| NCT02734173 | Completed | Hepatitis C |
Ottawa Hospital Research Institute|AbbVie |
July 2015 | Phase 4 |
| NCT01911845 | Completed | Chronic Hepatitis C Infection|Chronic Hepatitis C |
AbbVie |
April 2013 | Phase 2 |
Technischer Support
Tel: +1-832-582-8158 Ext:3
Wenn Sie weitere Fragen haben, hinterlassen Sie bitte eine Nachricht.
