nur für Forschungszwecke
Pitavastatin (NK-104) Calcium HMG-CoA Reductase Inhibitor
Kat.-Nr.S1759
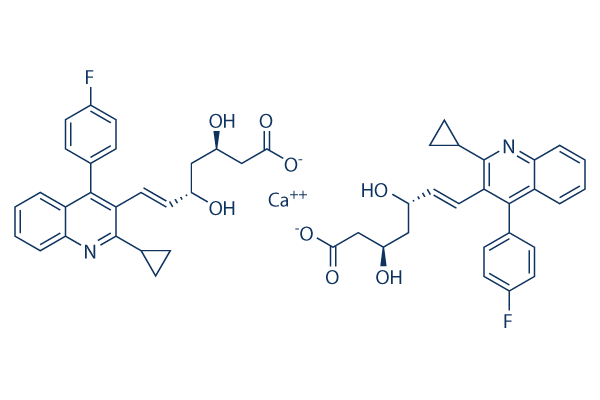
Chemische Struktur
Molekulargewicht: 880.98
Qualitätskontrolle
| Verwandte Ziele | Dehydrogenase HSP Transferase P450 (e.g. CYP17) PDE phosphatase PPAR Vitamin Carbohydrate Metabolism Mitochondrial Metabolism |
|---|---|
| Weitere HMG-CoA Reductase Inhibitoren | Mevastatin SR-12813 Clinofibrate Dihydrolanosterol 7-ketocholesterol Cerivastatin sodium |
Zellkultur, Behandlung & Arbeitskonzentration
| Zelllinien | Assay-Typ | Konzentration | Inkubationszeit | Formulierung | Aktivitätsbeschreibung | PMID |
|---|---|---|---|---|---|---|
| HEK293 | Function assay | Drug uptake in HEK293 cells expressing OATP1B1 (unknown origin) assessed as OATP1B1-mediated drug transport, Km = 4.8 μM. | 22587986 | |||
| hepatocytes | Function assay | 0.1 to 10 uM | up to 90 mins | Drug metabolism in Sprague-Dawley rat hepatocytes assessed per 10'6 cells at 0.1 to 10 uM up to 90 mins by media-loss method, Km = 13 μM. | 22593038 | |
| Neuro2a | Function assay | 1 uM | Inhibition of delta 8-7 isomerase in mouse Neuro2a cells assessed as decrease in 7-DHC levels at 1 uM by LC-MS/GC-MS analysis | 26789657 | ||
| Neuro2a | Function assay | 1 uM | Inhibition of DR24 in mouse Neuro2a cells assessed as decrease in 7-DHC levels at 1 uM by LC-MS/GC-MS analysis | 26789657 | ||
| Neuro2a | Function assay | 1 uM | Inhibition of HMGCoA reductase in Dhcr7-deficient mouse Neuro2a cells assessed as decrease in 7-DHC levels at 1 uM by LC-MS/GC-MS analysis | 26789657 | ||
| MCF-7 | Function assay | 10 uM | 24 hrs | Antagonist activity at Myc-tagged RXRalpha (unknown origin) expressed in human MCF-7 cells assessed as inhibition of 9-cis-RA induced receptor transactivation at 10 uM after 24 hrs by luciferase reporter gene assay | 28089347 | |
| MCF-7 | Function assay | 1 uM | 24 hrs | Antagonist activity at Myc-tagged RXRalpha (unknown origin) expressed in human MCF-7 cells assessed as inhibition of 9-cis-RA induced receptor transactivation at 1 uM after 24 hrs by luciferase reporter gene assay | 28089347 | |
| Klicken Sie hier, um weitere experimentelle Daten zu Zelllinien anzuzeigen | ||||||
Chemische Informationen, Lagerung & Stabilität
| Molekulargewicht | 880.98 | Formel | C50H46CaF2N2O8 |
Lagerung (Ab dem Eingangsdatum) | |
|---|---|---|---|---|---|
| CAS-Nr. | 147526-32-7 | SDF herunterladen | Lagerung von Stammlösungen |
|
|
| Synonyme | NK-104 calcium | Smiles | C1CC1C2=NC3=CC=CC=C3C(=C2C=CC(CC(CC(=O)[O-])O)O)C4=CC=C(C=C4)F.C1CC1C2=NC3=CC=CC=C3C(=C2C=CC(CC(CC(=O)[O-])O)O)C4=CC=C(C=C4)F.[Ca+2] | ||
Löslichkeit
|
In vitro |
DMSO
: 100 mg/mL
(113.5 mM)
Water : Insoluble Ethanol : Insoluble |
Molaritätsrechner
|
In vivo |
|||||
In-vivo-Formulierungsrechner (Klare Lösung)
Schritt 1: Geben Sie die untenstehenden Informationen ein (Empfohlen: Ein zusätzliches Tier zur Berücksichtigung von Verlusten während des Experiments)
Schritt 2: Geben Sie die In-vivo-Formulierung ein (Dies ist nur der Rechner, keine Formulierung. Bitte kontaktieren Sie uns zuerst, wenn es im Abschnitt "Löslichkeit" keine In-vivo-Formulierung gibt.)
Berechnungsergebnisse:
Arbeitskonzentration: mg/ml;
Methode zur Herstellung der DMSO-Stammlösung: mg Wirkstoff vorgelöst in μL DMSO ( Konzentration der Stammlösung mg/mL, Bitte kontaktieren Sie uns zuerst, wenn die Konzentration die DMSO-Löslichkeit der Wirkstoffcharge überschreitet. )
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügenμL PEG300, mischen und klären, dann hinzufügenμL Tween 80, mischen und klären, dann hinzufügen μL ddH2O, mischen und klären.
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügen μL Maisöl, mischen und klären.
Hinweis: 1. Bitte stellen Sie sicher, dass die Flüssigkeit klar ist, bevor Sie das nächste Lösungsmittel hinzufügen.
2. Achten Sie darauf, das/die Lösungsmittel der Reihe nach hinzuzufügen. Sie müssen sicherstellen, dass die bei der vorherigen Zugabe erhaltene Lösung eine klare Lösung ist, bevor Sie mit der Zugabe des nächsten Lösungsmittels fortfahren. Physikalische Methoden wie Vortex, Ultraschall oder ein heißes Wasserbad können zur Unterstützung des Lösens verwendet werden.
Wirkmechanismus
| Targets/IC50/Ki |
cholesterol esters
HMG-CoA reductase
|
|---|---|
| In vitro |
Pitavastatin reduziert signifikant sowohl die intrazellulären Spiegel als auch die Synthese von Cholesterinestern. Es wurde festgestellt, dass Pitavastatin die LDL-Rezeptor-Expression in vitro sowie die Menge der LDL-Bindung an den LDL-Rezeptor erhöht. Pitavastatin zeigt auch eine stärkere Induktion der LDL-Rezeptor-mRNA-Expression im Vergleich zu Simvastatin und Atorvastatin. Pitavastatin hat viele pleiotrope Wirkungen in vitro und in vivo, einschließlich der Verzögerung des Fortschreitens der Atherosklerose durch Hemmung der Thromboxan-Synthese, Hemmung der Migration/Proliferation von vaskulären glatten Muskelzellen, die durch Angiotensin II induziert werden, und Stabilisierung atherosklerotischer Plaques. Pitavastatin ist in der Lage, PPARα zu aktivieren und HDL apoA-I durch Induktion der Hemmung des Rho-Signalwegs zu induzieren. Pitavastatin (1 μM)-Behandlung für 48 h ist in der Lage, die Expression von Knochenmorphogenetischem Protein-2 BMP-2 (2,5-fach) und Osteocalcin (10-fach) durch Hemmung der Rho-assoziierten Kinase in menschlichen Osteoblasten zu verbessern. Pitavastatin hemmt das Wachstum und die Koloniebildung von Leberkrebs-Huh-7-Zellen und SMMC7721-Zellen. Es induziert den Arrest von Leberkrebszellen in der G1-Phase. Nach der Pitavastatin-Behandlung wird ein erhöhter Anteil an sub-G1-Zellen beobachtet. Pitavastatin fördert die Caspase-9-Spaltung und Caspase-3-Spaltung in Leberkrebszellen. Pitavastatin könnte NF-κB und Anti-Entzündung in hepatozellulären Karzinomzellen regulieren. Pitavastatin könnte autophagischen Zelltod in Gliomzellen induzieren und die Sensibilität von Zellen gegenüber Strahlentherapie fördern. Es könnte auch die Zellproliferation hemmen und die Zellapoptose in Cholangiokarzinomzellen induzieren.
|
| In vivo |
Pitavastatin verringert das Tumorwachstum und verbessert das Überleben tumorbeladener Mäuse. Pitavastatin übt eine schützende Wirkung auf die dilatative Kardiomyopathie aus, möglicherweise durch Herunterregulierung des zirkulierenden und lokalen RAS, gefolgt von der Hemmung der PKCb2-Phosphorylierung und folglich der Förderung der Phosphorylierung von PLB sowie der Aktivität und der Expressionen von SERCA2a und RyR2, wodurch die Herzfunktion bei der Entwicklung von DCM erhalten bleibt.
|
Literatur |
|
Anwendungen
| Methoden | Biomarker | Bilder | PMID |
|---|---|---|---|
| Western blot | Nrf2 / NQO1 / HO-1 Flt1 / Flk1 VEGF / p-Akt / AKT / Jagged-1 / c-Notch1 / Notch-1 / Hes-1 |
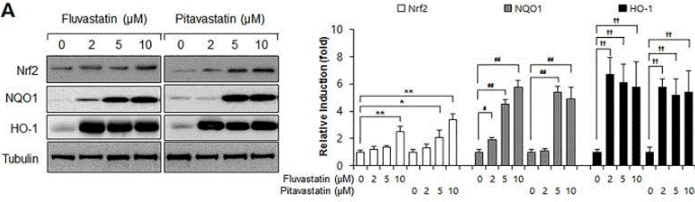
|
28542559 |
| Growth inhibition assay | Cell number |
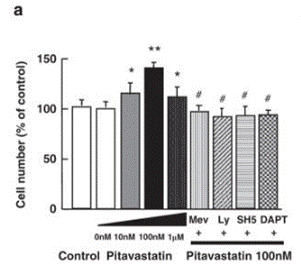
|
21301413 |
Klinische Studieninformationen
(Daten von https://clinicaltrials.gov, aktualisiert am 2024-05-22)
| NCT-Nummer | Rekrutierung | Erkrankungen | Sponsor/Kooperationspartner | Startdatum | Phasen |
|---|---|---|---|---|---|
| NCT05977738 | Recruiting | Glioblastoma Multiforme Adult|Recurrent Glioblastoma |
C.Dirven|Erasmus Medical Center |
January 18 2024 | Early Phase 1 |
| NCT04643093 | Completed | Primary Hypercholesterolemia|Mixed Dyslipidemias |
Orient Pharma Co. Ltd. |
August 1 2020 | Phase 3 |
Technischer Support
Tel: +1-832-582-8158 Ext:3
Wenn Sie weitere Fragen haben, hinterlassen Sie bitte eine Nachricht.
Häufig gestellte Fragen
Frage 1:
How to prepare the solution of it for in vivo use?
Antwort:
You could use the formulation: 5% DMSO +40%PEG 300+5%Tween80+ddH2O for i.p., at a working concentration of 12.5mg/ml, stable for no longer than 40min.
