nur für Forschungszwecke
S-Ruxolitinib (INCB018424) JAK Inhibitor
Kat.-Nr.S2902
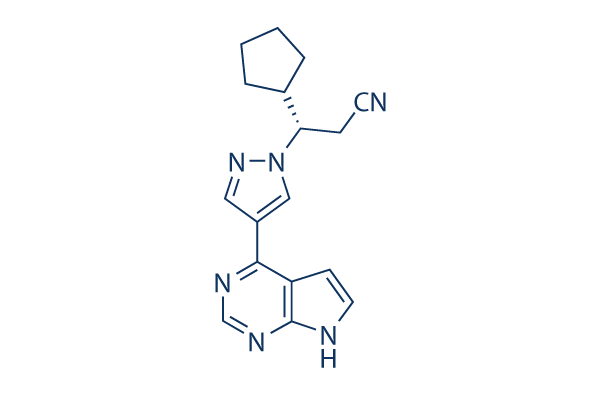
Chemische Struktur
Molekulargewicht: 306.37
Qualitätskontrolle
| Verwandte Ziele | EGFR STAT Pim |
|---|---|
| Weitere JAK Inhibitoren | BMS-986165 (Deucravacitinib) AZD1480 WP1066 Momelotinib (CYT387) Filgotinib (GLPG0634) AT9283 Gandotinib (LY2784544) Pacritinib TG101209 Cerdulatinib (PRT062070) hydrochloride |
Chemische Informationen, Lagerung & Stabilität
| Molekulargewicht | 306.37 | Formel | C17H18N6 |
Lagerung (Ab dem Eingangsdatum) | |
|---|---|---|---|---|---|
| CAS-Nr. | 941685-37-6 | SDF herunterladen | Lagerung von Stammlösungen |
|
|
| Synonyme | N/A | Smiles | C1CCC(C1)C(CC#N)N2C=C(C=N2)C3=C4C=CNC4=NC=N3 | ||
Löslichkeit
|
In vitro |
DMSO
: 61 mg/mL
(199.1 mM)
Ethanol : 61 mg/mL Water : Insoluble |
Molaritätsrechner
|
In vivo |
|||||
In-vivo-Formulierungsrechner (Klare Lösung)
Schritt 1: Geben Sie die untenstehenden Informationen ein (Empfohlen: Ein zusätzliches Tier zur Berücksichtigung von Verlusten während des Experiments)
Schritt 2: Geben Sie die In-vivo-Formulierung ein (Dies ist nur der Rechner, keine Formulierung. Bitte kontaktieren Sie uns zuerst, wenn es im Abschnitt "Löslichkeit" keine In-vivo-Formulierung gibt.)
Berechnungsergebnisse:
Arbeitskonzentration: mg/ml;
Methode zur Herstellung der DMSO-Stammlösung: mg Wirkstoff vorgelöst in μL DMSO ( Konzentration der Stammlösung mg/mL, Bitte kontaktieren Sie uns zuerst, wenn die Konzentration die DMSO-Löslichkeit der Wirkstoffcharge überschreitet. )
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügenμL PEG300, mischen und klären, dann hinzufügenμL Tween 80, mischen und klären, dann hinzufügen μL ddH2O, mischen und klären.
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügen μL Maisöl, mischen und klären.
Hinweis: 1. Bitte stellen Sie sicher, dass die Flüssigkeit klar ist, bevor Sie das nächste Lösungsmittel hinzufügen.
2. Achten Sie darauf, das/die Lösungsmittel der Reihe nach hinzuzufügen. Sie müssen sicherstellen, dass die bei der vorherigen Zugabe erhaltene Lösung eine klare Lösung ist, bevor Sie mit der Zugabe des nächsten Lösungsmittels fortfahren. Physikalische Methoden wie Vortex, Ultraschall oder ein heißes Wasserbad können zur Unterstützung des Lösens verwendet werden.
Wirkmechanismus
| Targets/IC50/Ki |
JAK2
(Cell-free assay) 2.8 nM
JAK1
(Cell-free assay) 3.3 nM
TYK2
(Cell-free assay) 19 nM
|
|---|---|
| In vitro |
S-Ruxolitinib (INCB018424) hemmt potent und selektiv die JAK2V617F-vermittelte Signalübertragung und Proliferation in Ba/F3-Zellen und HEL-Zellen. Es erhöht die Apoptose in Ba/F3-Zellen dosisabhängig signifikant. Diese Verbindung (64 nM) führt zu einer Verdoppelung der Zellen mit depolarisierten Mitochondrien in Ba/F3-Zellen. Es hemmt die Proliferation erythroidaler Vorläuferzellen von Normalspendern und Polycythämia vera-Patienten mit einer IC50 von 407 nM bzw. 223 nM. INCB018424 zeigt eine bemerkenswerte Potenz gegen die Bildung erythroidaler Kolonien mit einer IC50 von 67nM.
|
| Kinase-Assay |
Bindungsassay
|
|
Rekombinante Proteine werden mittels Sf21-Zellen und Baculovirus-Vektoren exprimiert und mittels Affinitätschromatographie gereinigt. JAK-Kinase-Assays verwenden einen homogenen zeitaufgelösten Fluoreszenz-Assay mit dem Peptidsubstrat (-EQEDEPEGDYFEWLE). Jede Enzymreaktion wird mit S-Ruxolitinib (INCB018424) oder Kontrolle, JAK-Enzym, 500 nM Peptid, Adenosintriphosphat (ATP; 1 mM) und 2% Dimethylsulfoxid (DMSO) für 1 Stunde durchgeführt. Die 50%ige Hemmkonzentration (IC50) wird als die Konzentration dieser Verbindung berechnet, die zur Hemmung von 50% des Fluoreszenzsignals erforderlich ist.
|
|
| In vivo |
S2902 (180 mg/kg, oral, zweimal täglich) führt in einem JAK2V617F-gesteuerten Mausmodell bis Tag 22 zu einer Überlebensrate von über 90%. S2902 (180 mg/kg, oral, zweimal täglich) reduziert signifikant Splenomegalie und zirkulierende Entzündungszytokine und eliminiert bevorzugt neoplastische Zellen, was zu einem signifikant verlängerten Überleben ohne myelosuppressive oder immunsuppressive Effekte in einem JAK2V617F-gesteuerten Mausmodell führt. Der primäre Endpunkt wird bei 41,9% der Patienten in der S2902-Gruppe im Vergleich zu 0,7% in der Placebo-Gruppe in der doppelblinden Studie zur Myelofibrose erreicht. Ruxolitinib führt zur Aufrechterhaltung der Reduktion des Milzvolumens und einer Verbesserung von 50% oder mehr des gesamten Symptom-Scores. Insgesamt 28% der Patienten in der S2902-Gruppe (15 mg zweimal täglich) weisen bei Patienten mit Myelofibrose nach 48 Wochen eine Milzvolumenreduktion von mindestens 35% auf, verglichen mit 0% in der Gruppe, die die beste verfügbare Therapie erhielt. Die mittlere palpable Milzlänge ist unter S2902 um 56% gesunken, aber unter der besten verfügbaren Therapie nach 48 Wochen um 4% gestiegen. Patienten in der S2902-Gruppe zeigen eine Verbesserung der allgemeinen Lebensqualitätsmaße und eine Reduktion der mit Myelofibrose verbundenen Symptome.
|
Literatur |
|
Klinische Studieninformationen
(Daten von https://clinicaltrials.gov, aktualisiert am 2024-05-22)
| NCT-Nummer | Rekrutierung | Erkrankungen | Sponsor/Kooperationspartner | Startdatum | Phasen |
|---|---|---|---|---|---|
| NCT06310304 | Active not recruiting | Healthy Participants |
Incyte Corporation |
March 26 2024 | Phase 1 |
| NCT02596347 | Completed | Chronic Beryllium Disease (CBD)|Beryllium Sensitization (BeS) |
National Jewish Health |
April 2015 | -- |
| NCT00617994 | Completed | Psoriasis |
Incyte Corporation |
August 31 2007 | Phase 2 |
Technischer Support
Tel: +1-832-582-8158 Ext:3
Wenn Sie weitere Fragen haben, hinterlassen Sie bitte eine Nachricht.
