nur für Forschungszwecke
Vonoprazan Fumarate (TAK-438) Potassium Channel Inhibitor
Kat.-Nr.S8016
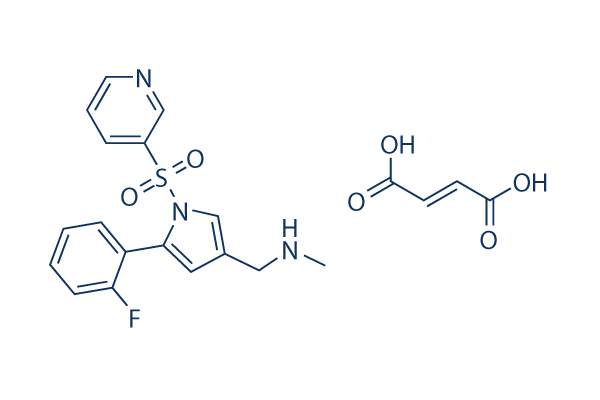
Chemische Struktur
Molekulargewicht: 461.46
Qualitätskontrolle
| Verwandte Ziele | CFTR CRM1 CD markers AChR Calcium Channel Sodium Channel GABA Receptor TRP Channel ATPase GluR |
|---|---|
| Weitere Potassium Channel Inhibitoren | TRAM-34 Nicorandil ML133 HCl Sophocarpine Hydralazine HCl Nigericin Gliquidone E-4031 dihydrochloride PAP-1 Ajmaline |
Chemische Informationen, Lagerung & Stabilität
| Molekulargewicht | 461.46 | Formel |
C17H16FN3O2S.C4H4O4
|
Lagerung (Ab dem Eingangsdatum) | |
|---|---|---|---|---|---|
| CAS-Nr. | 1260141-27-2 | SDF herunterladen | Lagerung von Stammlösungen |
|
|
| Synonyme | N/A | Smiles | CNCC1=CN(C(=C1)C2=CC=CC=C2F)S(=O)(=O)C3=CN=CC=C3.C(=CC(=O)O)C(=O)O | ||
Löslichkeit
|
In vitro |
DMSO
: 92 mg/mL
(199.36 mM)
Water : Insoluble Ethanol : Insoluble |
Molaritätsrechner
|
In vivo |
|||||
In-vivo-Formulierungsrechner (Klare Lösung)
Schritt 1: Geben Sie die untenstehenden Informationen ein (Empfohlen: Ein zusätzliches Tier zur Berücksichtigung von Verlusten während des Experiments)
Schritt 2: Geben Sie die In-vivo-Formulierung ein (Dies ist nur der Rechner, keine Formulierung. Bitte kontaktieren Sie uns zuerst, wenn es im Abschnitt "Löslichkeit" keine In-vivo-Formulierung gibt.)
Berechnungsergebnisse:
Arbeitskonzentration: mg/ml;
Methode zur Herstellung der DMSO-Stammlösung: mg Wirkstoff vorgelöst in μL DMSO ( Konzentration der Stammlösung mg/mL, Bitte kontaktieren Sie uns zuerst, wenn die Konzentration die DMSO-Löslichkeit der Wirkstoffcharge überschreitet. )
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügenμL PEG300, mischen und klären, dann hinzufügenμL Tween 80, mischen und klären, dann hinzufügen μL ddH2O, mischen und klären.
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügen μL Maisöl, mischen und klären.
Hinweis: 1. Bitte stellen Sie sicher, dass die Flüssigkeit klar ist, bevor Sie das nächste Lösungsmittel hinzufügen.
2. Achten Sie darauf, das/die Lösungsmittel der Reihe nach hinzuzufügen. Sie müssen sicherstellen, dass die bei der vorherigen Zugabe erhaltene Lösung eine klare Lösung ist, bevor Sie mit der Zugabe des nächsten Lösungsmittels fortfahren. Physikalische Methoden wie Vortex, Ultraschall oder ein heißes Wasserbad können zur Unterstützung des Lösens verwendet werden.
Wirkmechanismus
| Merkmale |
Capable of inhibiting H+, K+-ATPase under acidic or neutral conditions.
|
|---|---|
| Targets/IC50/Ki |
H+/K+-ATPase
19 nM
|
| In vitro |
Vonoprazan Fumarate (TAK-438) ist ein Pyrrolderivat mit einer chemischen Struktur, die sich vollständig von den bisher entwickelten P-CABs unterscheidet. Es hemmt die H+, K+-ATPase-Aktivität im Magen konzentrationsabhängig. Unter neutralen Bedingungen (pH 7,5) ist die hemmende Aktivität dieser Verbindung fast dieselbe wie unter schwach sauren Bedingungen (pH 6,5). Es hemmt die Na+, K+-ATPase-Aktivität selbst bei Konzentrationen, die 500-mal höher sind als ihre IC50-Werte gegen die H+,K+-ATPase-Aktivität im Magen, nicht. Diese Verbindung hemmt die H+, K+-ATPase im Magen auf eine K+-kompetitive Weise mit einem Ki von 3 nM.
|
| In vivo |
Vonoprazan Fumarate (TAK-438) hemmt die basale Magensäuresekretion dosisabhängig, und der ID50-Wert beträgt 1,26 mg/kg. Die intravenöse Verabreichung dieser Verbindung erhöht den pH-Wert des Magenperfusats dosisabhängig, und der pH-Anstieg hält 5 Stunden nach der Verabreichung an. Bei der Dosis von 1 mg/kg erreicht der pH-Wert 90 Minuten nach der Verabreichung ein Plateau, und der höchste erreichte pH-Wert beträgt 5,9. Darüber hinaus zeigt es eine potente und länger anhaltende hemmende Wirkung auf die Histamin-stimulierte Magensäuresekretion bei Ratten und Hunden. Es zeigt eine signifikante antisekretorische Aktivität durch hohe Akkumulation und langsame Clearance aus dem Magengewebe. Diese Verbindung wird im Gegensatz zu PPIs nicht vom Magen-Sekretionszustand beeinflusst.
|
Literatur |
|
Klinische Studieninformationen
(Daten von https://clinicaltrials.gov, aktualisiert am 2024-05-22)
| NCT-Nummer | Rekrutierung | Erkrankungen | Sponsor/Kooperationspartner | Startdatum | Phasen |
|---|---|---|---|---|---|
| NCT03808493 | Completed | Japanese Healthy Adult Male |
Takeda |
January 30 2019 | Phase 1 |
| NCT03456960 | Completed | Healthy Volunteers |
Takeda |
March 8 2018 | Phase 1 |
| NCT03085836 | Completed | Healthy Participants |
Takeda |
April 19 2017 | Phase 1 |
| NCT02774902 | Completed | Healthy Volunteers |
Takeda |
August 2010 | Phase 1 |
| NCT02141711 | Completed | Erosive Esophagitis(EE)|Gastroesophageal Reflux Disease (GERD) |
Takeda |
October 2008 | Phase 1 |
| NCT02123953 | Completed | Dose Finding Study |
Takeda |
October 2008 | Phase 1 |
Technischer Support
Tel: +1-832-582-8158 Ext:3
Wenn Sie weitere Fragen haben, hinterlassen Sie bitte eine Nachricht.
