nur für Forschungszwecke
AZ 960 JAK Inhibitor
Kat.-Nr.S2214
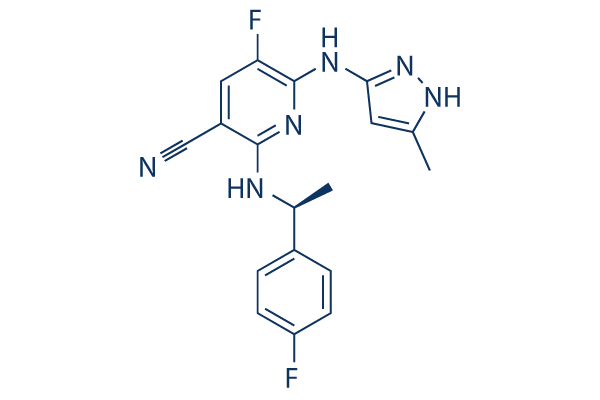
Chemische Struktur
Molekulargewicht: 354.36
Qualitätskontrolle
- In Nature Medicine für seine erstklassige Qualität zitiert
- COA
- NMR
- HPLC
- SDS
- Datenblatt
| Verwandte Ziele | EGFR STAT Pim |
|---|---|
| Weitere JAK Inhibitoren | BMS-986165 (Deucravacitinib) AZD1480 WP1066 Momelotinib (CYT387) Filgotinib (GLPG0634) AT9283 Gandotinib (LY2784544) Pacritinib TG101209 Cerdulatinib (PRT062070) hydrochloride |
Chemische Informationen, Lagerung & Stabilität
| Molekulargewicht | 354.36 | Formel | C18H16F2N6 |
Lagerung (Ab dem Eingangsdatum) | |
|---|---|---|---|---|---|
| CAS-Nr. | 905586-69-8 | SDF herunterladen | Lagerung von Stammlösungen |
|
|
| Synonyme | N/A | Smiles | CC1=CC(=NN1)NC2=C(C=C(C(=N2)NC(C)C3=CC=C(C=C3)F)C#N)F | ||
Löslichkeit
|
In vitro |
DMSO
: 71 mg/mL
(200.36 mM)
Ethanol : 3 mg/mL Water : Insoluble |
Molaritätsrechner
|
In vivo |
|||||
In-vivo-Formulierungsrechner (Klare Lösung)
Schritt 1: Geben Sie die untenstehenden Informationen ein (Empfohlen: Ein zusätzliches Tier zur Berücksichtigung von Verlusten während des Experiments)
Schritt 2: Geben Sie die In-vivo-Formulierung ein (Dies ist nur der Rechner, keine Formulierung. Bitte kontaktieren Sie uns zuerst, wenn es im Abschnitt "Löslichkeit" keine In-vivo-Formulierung gibt.)
Berechnungsergebnisse:
Arbeitskonzentration: mg/ml;
Methode zur Herstellung der DMSO-Stammlösung: mg Wirkstoff vorgelöst in μL DMSO ( Konzentration der Stammlösung mg/mL, Bitte kontaktieren Sie uns zuerst, wenn die Konzentration die DMSO-Löslichkeit der Wirkstoffcharge überschreitet. )
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügenμL PEG300, mischen und klären, dann hinzufügenμL Tween 80, mischen und klären, dann hinzufügen μL ddH2O, mischen und klären.
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügen μL Maisöl, mischen und klären.
Hinweis: 1. Bitte stellen Sie sicher, dass die Flüssigkeit klar ist, bevor Sie das nächste Lösungsmittel hinzufügen.
2. Achten Sie darauf, das/die Lösungsmittel der Reihe nach hinzuzufügen. Sie müssen sicherstellen, dass die bei der vorherigen Zugabe erhaltene Lösung eine klare Lösung ist, bevor Sie mit der Zugabe des nächsten Lösungsmittels fortfahren. Physikalische Methoden wie Vortex, Ultraschall oder ein heißes Wasserbad können zur Unterstützung des Lösens verwendet werden.
Wirkmechanismus
| Targets/IC50/Ki |
JAK2
0.45 nM(Ki)
JAK2
<3 nM
|
|---|---|
| In vitro |
AZ960 hemmt auch viele Kinasen zu weniger als 50 % bei einer Konzentration von 0,1 μM, wie JAK3 (IC50=9 nM), TrkA, Aurora und ARK5. In Zellen hemmt diese Verbindung die Phosphorylierung von STAT5 in TEL-JAK2-Zellen mit einem durchschnittlichen IC50 von 15 nM und zeigt eine 15- bis 30-fache Empfindlichkeit für die TEL-JAK2-gesteuerte STAT5-Phosphorylierung im Vergleich zu Zelllinien, die von anderen JAK-Kinase-Familienmitgliedern (TEL-JAK1, -JAK3 und -TYK2) gesteuert werden. Es zeigt eine potente Aktivität bei der Hemmung der Proliferation der TEL-JAK2-, -JAK1-, -JAK3- und -Tyk2-Zelllinien mit GI50-Werten von 25 nM, 230 nM, 279 nM bzw. 214 nM. Darüber hinaus hemmt diese Chemikalie auch die Proliferation von SET-2-Zellen potent mit einem durchschnittlichen GI50 von 33 nM durch die Reduzierung der Phosphorylierungsgrade von STAT3 und STAT5. Es verursacht Wachstumsstillstand und Apoptose von humanem T-Zell-lymphotropem Virus Typ 1, HTLV-1pe 1, HTLV-1LV-1ose von humanem T-cSET-2 Zellproliferation mitBcl-xL durch kleine interferierende RNA verstärkt die antiproliferativen Wirkungen von AZ 960 in MT-1-Zellen. Eine aktuelle Studie zeigt, dass diese Verbindung zu einer signifikanten Hemmung des klonogenen Wachstums und zur Induktion der Apoptose von frisch isolierten AML-Zellen von Patienten führt.
|
| Kinase-Assay |
Enzym-Biochemischer Assay und Kinase-Profilierung
|
|
Hemmstudien von AZ 960 werden unter Verwendung einer rekombinanten JAK2-Kinase (Aminosäuren 808–1132) bei einer Peptidkonzentration (Tyk2-Peptid) von 100 nM und einer ATP-Konzentration von 15 μM durchgeführt. Es werden Konzentrationen dieser Verbindung im Bereich von 0,003 μM bis 30 μM verwendet. Der Hemmmodus und die Hemmkonstante (Ki) dieser Verbindung gegen JAK2-Kinase werden durch Hemmkinetik weiter evaluiert. Insbesondere wird eine Reihe von JAK2-katalysierten Reaktionen in HEPES-Puffer (75 mM, pH 7,3) mit einer festen Peptidkonzentration (FL-Ahx-IPTSPITTTYFFFKKK-COOH) und variierten Konzentrationen von ATP und dieser Chemikalie durchgeführt. Der Fortschritt jeder Reaktion wird anschließend durch das Caliper LC3000-System überwacht, und die Anfangsgeschwindigkeit jeder Reaktion wird aus dem entsprechenden Reaktionszeitverlauf extrahiert. Um den Hemmmodus zu definieren, werden die Anfangsgeschwindigkeiten gegen die entsprechenden ATP-Konzentrationen unter Verwendung von Lineweaver-Burk-Diagrammen aufgetragen, und die charakteristische Konvergenz der Linien auf der y-Achse zeigt die Kompetitivität dieser Verbindung zu ATP. Eine erste Untersuchung von Ki unter Verwendung der Michaelis-Menten-Gleichung zeigte, dass diese Verbindung ein eng bindender Inhibitor von JAK2 ist. Diese Chemikalie wird gegen 83 Kinasen bei drei Inhibitor-Konzentrationen (0,01 μM, 0,10 μM und 1,0 μM) profiliert.
|
Literatur |
|
Technischer Support
Tel: +1-832-582-8158 Ext:3
Wenn Sie weitere Fragen haben, hinterlassen Sie bitte eine Nachricht.
