nur für Forschungszwecke
Fluvastatin Sodium HMG-CoA Reductase Inhibitor
Kat.-Nr.S1909
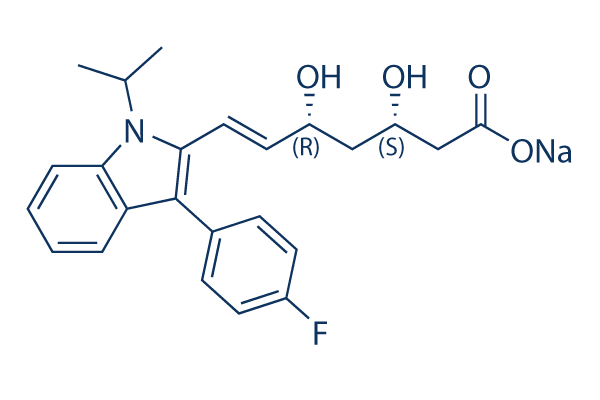
Chemische Struktur
Molekulargewicht: 433.45
Qualitätskontrolle
| Verwandte Ziele | Dehydrogenase HSP Transferase P450 (e.g. CYP17) PDE phosphatase PPAR Vitamin Carbohydrate Metabolism Mitochondrial Metabolism |
|---|---|
| Weitere HMG-CoA Reductase Inhibitoren | Mevastatin SR-12813 Clinofibrate Dihydrolanosterol 7-ketocholesterol Cerivastatin sodium |
Chemische Informationen, Lagerung & Stabilität
| Molekulargewicht | 433.45 | Formel | C24H25FNNaO4 |
Lagerung (Ab dem Eingangsdatum) | |
|---|---|---|---|---|---|
| CAS-Nr. | 93957-55-2 | SDF herunterladen | Lagerung von Stammlösungen |
|
|
| Synonyme | XU-62-320 Sodium | Smiles | CC(C)N1C2=CC=CC=C2C(=C1C=CC(CC(CC(=O)[O-])O)O)C3=CC=C(C=C3)F.[Na+] | ||
Löslichkeit
|
In vitro |
DMSO
: 87 mg/mL
(200.71 mM)
Water : 18 mg/mL Ethanol : Insoluble |
Molaritätsrechner
|
In vivo |
|||||
In-vivo-Formulierungsrechner (Klare Lösung)
Schritt 1: Geben Sie die untenstehenden Informationen ein (Empfohlen: Ein zusätzliches Tier zur Berücksichtigung von Verlusten während des Experiments)
Schritt 2: Geben Sie die In-vivo-Formulierung ein (Dies ist nur der Rechner, keine Formulierung. Bitte kontaktieren Sie uns zuerst, wenn es im Abschnitt "Löslichkeit" keine In-vivo-Formulierung gibt.)
Berechnungsergebnisse:
Arbeitskonzentration: mg/ml;
Methode zur Herstellung der DMSO-Stammlösung: mg Wirkstoff vorgelöst in μL DMSO ( Konzentration der Stammlösung mg/mL, Bitte kontaktieren Sie uns zuerst, wenn die Konzentration die DMSO-Löslichkeit der Wirkstoffcharge überschreitet. )
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügenμL PEG300, mischen und klären, dann hinzufügenμL Tween 80, mischen und klären, dann hinzufügen μL ddH2O, mischen und klären.
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügen μL Maisöl, mischen und klären.
Hinweis: 1. Bitte stellen Sie sicher, dass die Flüssigkeit klar ist, bevor Sie das nächste Lösungsmittel hinzufügen.
2. Achten Sie darauf, das/die Lösungsmittel der Reihe nach hinzuzufügen. Sie müssen sicherstellen, dass die bei der vorherigen Zugabe erhaltene Lösung eine klare Lösung ist, bevor Sie mit der Zugabe des nächsten Lösungsmittels fortfahren. Physikalische Methoden wie Vortex, Ultraschall oder ein heißes Wasserbad können zur Unterstützung des Lösens verwendet werden.
Wirkmechanismus
| Merkmale |
The order of magnitude of inhibition of each drug on the peroxidation was butylated hydroxytoluene > fluvastatin ≥ probucol ≥ pravastatin.
|
|---|---|
| Targets/IC50/Ki |
HMG-CoA reductase
(Cell-free assay) 8 nM
|
| In vitro |
Fluvastatin hemmt die Bildung thiobarbitursäure-reaktiver Substanzen bei der Eisen(II)-unterstützten Peroxidation von Liposomen mit einer IC50 von 12 ", "M erheblich. Fluvastatin im Bereich von 1 ", "M bis 100 ", "M hemmt die durch Peroxylradikale vermittelte Peroxidation von Liposomen, die durch wasserlösliche und lipidlösliche Radikalgeneratoren, 2,2'-Azobis(2-amidinopropan)dihydrochlorid bzw. 2,2'-Azobis(2,4-dimethylvaleronitril), induziert wird. Fluvastatin (4 mM) und seine Metaboliten zeigen eine Superoxidanionen-Abfangaktivität im Hypoxanthin-Xanthinoxidase-System und eine starke Abfangwirkung auf das Hydroxylradikal, das aus der Fenton-Reaktion entsteht. Fluvastatin (8 ", "M) und seine Metaboliten zeigen schützende Wirkungen gegen DNA-Schäden, die so stark sind wie die der Referenz-Antioxidantien Ascorbinsäure, Trolox und Probucol in CHL/IU-Zellen. Fluvastatin (100 nM) zeigt eine dosisabhängige Abnahme der Ang II-aktivierten Superoxidanionenbildung in menschlichen Aortenmuskelzellen (hASMC). |
| In vivo |
Fluvastatin (10 mg/kg/Tag) führt zu einer Abnahme der Serumlipide bei Kaninchen, die mit einer 1,5%igen Cholesterin-haltigen Diät gefüttert wurden. Fluvastatin (10 mg/kg/Tag) senkt signifikant das Gewebe-ACE in den Aorten bei Kaninchen, die mit einer 1,5%igen Cholesterin-haltigen Diät gefüttert wurden. Fluvastatin (10 mg/kg/Tag) kehrt die Unterdrückung der ACh-induzierten Relaxation bei Kaninchen, die mit einer 1,5%igen Cholesterin-haltigen Diät gefüttert wurden, signifikant um. |
Literatur |
|
Anwendungen
| Methoden | Biomarker | Bilder | PMID |
|---|---|---|---|
| Growth inhibition assay | Cell viability |
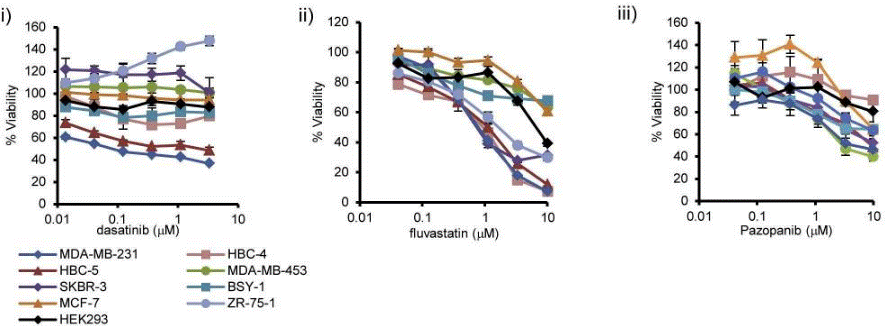
|
26199863 |
| Western blot | p53 / p21 / Cyclin D1 / ATF3 / H3P / PARP / Cleaved PARP / γ-H2AX YAP1 / TAZ / RHAMM |
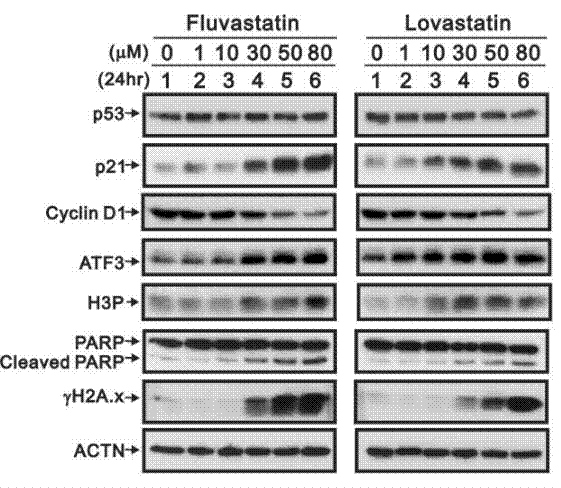
|
30939155 |
| Immunofluorescence | YAP1 |
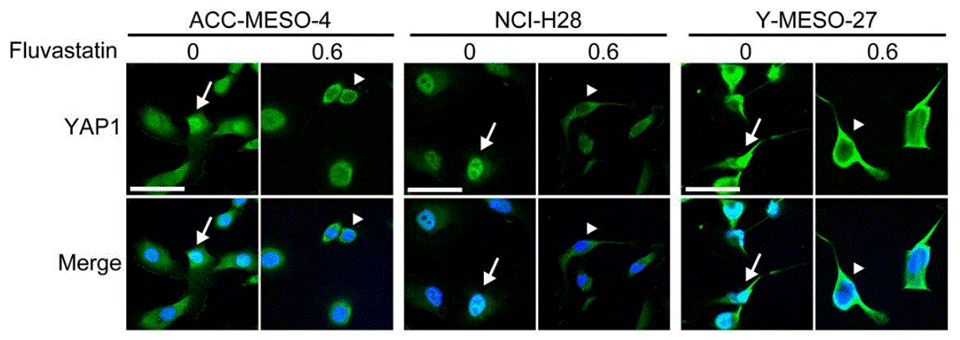
|
29212185 |
Klinische Studieninformationen
(Daten von https://clinicaltrials.gov, aktualisiert am 2024-05-22)
| NCT-Nummer | Rekrutierung | Erkrankungen | Sponsor/Kooperationspartner | Startdatum | Phasen |
|---|---|---|---|---|---|
| NCT02115074 | Completed | Glioma |
Centre Oscar Lambret|Anticancer Fund Belgium |
June 2014 | Phase 1 |
| NCT01524601 | Completed | Disorder Related to Renal Transplantation|Hypercholesterolemia |
University of Oslo School of Pharmacy|Oslo University Hospital |
February 2012 | Phase 4 |
| NCT00814606 | Withdrawn | Hepatitis C|Hepatitis C Virus |
University of Chicago |
February 2010 | Phase 2 |
| NCT00752843 | Completed | Healthy Subjects |
Corcept Therapeutics |
September 2008 | Phase 1 |
| NCT00674297 | Completed | Antiphospholipid Syndrome |
Hospital for Special Surgery New York|University of Texas |
May 2008 | Phase 2 |
| NCT00404287 | Terminated | Aortic Valve Stenosis |
AORTICA Group |
October 1 2006 | Phase 4 |
Technischer Support
Tel: +1-832-582-8158 Ext:3
Wenn Sie weitere Fragen haben, hinterlassen Sie bitte eine Nachricht.
