nur für Forschungszwecke
Odanacatib Cysteine Protease Inhibitor
Kat.-Nr.S1115
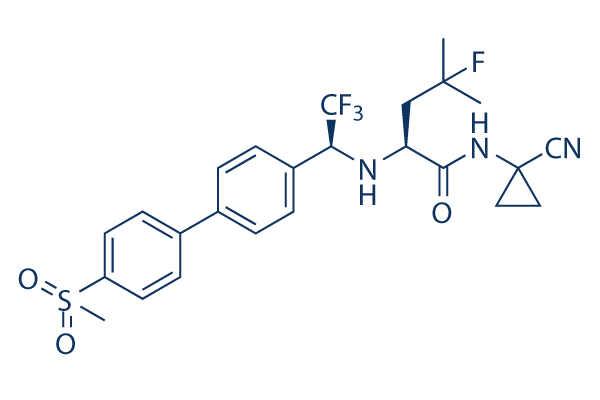
Chemische Struktur
Molekulargewicht: 525.56
Qualitätskontrolle
| Verwandte Ziele | HDAC Caspase Proteasome Secretase MMP HCV Protease DPP Tyrosinase HIV Protease Serine Protease |
|---|---|
| Weitere Cysteine Protease Inhibitoren | N-Ethylmaleimide (NEM) MG132 SSS Calpeptin Aloxistatin (E-64d) E-64 MG-101 (ALLN) Z-FA-FMK Cathepsin Inhibitor 1 PD 151746 Loxistatin Acid (E-64C) |
Zellkultur, Behandlung & Arbeitskonzentration
| Zelllinien | Assay-Typ | Konzentration | Inkubationszeit | Formulierung | Aktivitätsbeschreibung | PMID |
|---|---|---|---|---|---|---|
| ramos cells | Function assay | Inhibition of cathepsin S in human ramos cells, IC50=0.045μM | 18226527 | |||
| stem cells | Function assay | 7 days | Inhibition of osteoclastogenesis in human bone marrow-derived stem cells assessed as reduction of pit formation by measuring TRACP5b activity after 7 days by bone TRAP assay, IC50=0.1μM | 22984809 | ||
| HepG2 | Function assay | Inhibition of cathepsin B in human HepG2 cells, IC50=1.05μM | 18226527 | |||
| B cells | Function assay | Inhibition of antigen presenting mouse B cells, IC50=1.5μM | 18226527 | |||
| HepG2 | Function assay | Inhibition of cathepsin L in human HepG2 cells, IC50=4.843μM | 18226527 | |||
| SJ-GBM2 | qHTS assay | qHTS of pediatric cancer cell lines to identify multiple opportunities for drug repurposing: Primary screen for SJ-GBM2 cells | 29435139 | |||
| Klicken Sie hier, um weitere experimentelle Daten zu Zelllinien anzuzeigen | ||||||
Chemische Informationen, Lagerung & Stabilität
| Molekulargewicht | 525.56 | Formel | C25H27F4N3O3S |
Lagerung (Ab dem Eingangsdatum) | |
|---|---|---|---|---|---|
| CAS-Nr. | 603139-19-1 | SDF herunterladen | Lagerung von Stammlösungen |
|
|
| Synonyme | MK-0822 | Smiles | CC(C)(CC(C(=O)NC1(CC1)C#N)NC(C2=CC=C(C=C2)C3=CC=C(C=C3)S(=O)(=O)C)C(F)(F)F)F | ||
Löslichkeit
|
In vitro |
DMSO
: 100 mg/mL
(190.27 mM)
Water : Insoluble Ethanol : Insoluble |
Molaritätsrechner
|
In vivo |
|||||
In-vivo-Formulierungsrechner (Klare Lösung)
Schritt 1: Geben Sie die untenstehenden Informationen ein (Empfohlen: Ein zusätzliches Tier zur Berücksichtigung von Verlusten während des Experiments)
Schritt 2: Geben Sie die In-vivo-Formulierung ein (Dies ist nur der Rechner, keine Formulierung. Bitte kontaktieren Sie uns zuerst, wenn es im Abschnitt "Löslichkeit" keine In-vivo-Formulierung gibt.)
Berechnungsergebnisse:
Arbeitskonzentration: mg/ml;
Methode zur Herstellung der DMSO-Stammlösung: mg Wirkstoff vorgelöst in μL DMSO ( Konzentration der Stammlösung mg/mL, Bitte kontaktieren Sie uns zuerst, wenn die Konzentration die DMSO-Löslichkeit der Wirkstoffcharge überschreitet. )
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügenμL PEG300, mischen und klären, dann hinzufügenμL Tween 80, mischen und klären, dann hinzufügen μL ddH2O, mischen und klären.
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügen μL Maisöl, mischen und klären.
Hinweis: 1. Bitte stellen Sie sicher, dass die Flüssigkeit klar ist, bevor Sie das nächste Lösungsmittel hinzufügen.
2. Achten Sie darauf, das/die Lösungsmittel der Reihe nach hinzuzufügen. Sie müssen sicherstellen, dass die bei der vorherigen Zugabe erhaltene Lösung eine klare Lösung ist, bevor Sie mit der Zugabe des nächsten Lösungsmittels fortfahren. Physikalische Methoden wie Vortex, Ultraschall oder ein heißes Wasserbad können zur Unterstützung des Lösens verwendet werden.
Wirkmechanismus
| Merkmale |
A potent, selective, and neutral cathepsin K inhibitor.
|
|---|---|
| Targets/IC50/Ki |
Cathepsin K (human)
0.2 nM
Cathepsin K (rabbit)
1 nM
|
| In vitro |
In vitro zeigt Odanacatib eine hohe inhibitorische Aktivität und Selektivität für Cathepsin K mit IC50-Werten von 0,2 nM bzw. 1 nM für menschliches Cathepsin K und Kaninchen-Cathepsin K. Darüber hinaus zeigt diese Verbindung ähnliche Potenzen in zellulären Enzymbelegungsassays mit korrigierten IC50-Werten von 5 nM. Eine aktuelle Studie zeigt, dass diese Chemikalie zu einer Reduktion der Resorptionsaktivität von Osteoklasten (OC) führt, indem sie den intrazellulären vesikulären Transport unterbricht.
|
| In vivo |
In präklinischen Ratten zeigt Odanacatib (10 mg/kg) eine ausgezeichnete Pharmakokinetik mit einer Clearance (Cl: 2 mL kg-1 min-1), einem geringen Verteilungsvolumen (Vdss: 1,1 L kg-1), einer Halbwertszeit (T1/2: 6 Stunden) und einer oralen Bioverfügbarkeit (F: 8 %). Außerdem weist diese Verbindung eine ausgezeichnete metabolische Stabilität in Rattenhepatozyten mit einer 96%igen Wiederfindung der Ausgangssubstanz auf. Diese Chemikalie, p.o. verabreicht, verhindert dosisabhängig Knochenverlust bei ovariektomierten (OVX) Kaninchen. Darüber hinaus führt sie (9 µM/Tag) zu einem signifikanten Anstieg der Knochenmineraldichte (BMD) des proximalen Femurs (7,8 %), der femoralen Hals-BMD (10,8 %) und der Trochanter-major-BMD (6,5 %). Bei östrogenmangelhaften, skelettreifen Rhesusaffen hemmt eine Langzeitbehandlung mit dieser Verbindung effektiv den Knochenumbau, ohne die Anzahl der Osteoklasten zu reduzieren, und erhält die normalen biomechanischen Eigenschaften der Wirbelsäule von OVX-nichtmenschlichen Primaten.
|
Literatur |
|
Klinische Studieninformationen
(Daten von https://clinicaltrials.gov, aktualisiert am 2024-05-22)
| NCT-Nummer | Rekrutierung | Erkrankungen | Sponsor/Kooperationspartner | Startdatum | Phasen |
|---|---|---|---|---|---|
| NCT01803607 | Terminated | Osteoporosis |
Merck Sharp & Dohme LLC |
March 14 2013 | Phase 3 |
| NCT01630616 | Terminated | Osteoporosis |
Merck Sharp & Dohme LLC |
March 12 2013 | Phase 1 |
| NCT01512693 | Completed | Hepatic Insufficiency |
Merck Sharp & Dohme LLC |
February 23 2012 | Phase 1 |
| NCT01512667 | Completed | Renal Insufficiency |
Merck Sharp & Dohme LLC |
January 17 2012 | Phase 1 |
| NCT01068262 | Completed | Osteoporosis |
Merck Sharp & Dohme LLC |
December 8 2009 | Phase 1 |
| NCT00691899 | Withdrawn | Prostate Cancer |
Merck Sharp & Dohme LLC |
September 2008 | Phase 3 |
Technischer Support
Tel: +1-832-582-8158 Ext:3
Wenn Sie weitere Fragen haben, hinterlassen Sie bitte eine Nachricht.
