nur für Forschungszwecke
b-AP15 DUB Inhibitor
Kat.-Nr.S4920
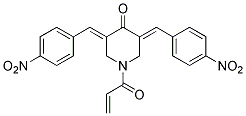
Chemische Struktur
Molekulargewicht: 419.39
Qualitätskontrolle
| Verwandte Ziele | Proteasome E1 Activating E3 Ligase p97 SUMO E2 conjugating |
|---|---|
| Weitere DUB Inhibitoren | PR-619 P5091 IU1 P22077 ML323 LDN-57444 VLX1570 TCID EOAI3402143 ML364 |
Zellkultur, Behandlung & Arbeitskonzentration
| Zelllinien | Assay-Typ | Konzentration | Inkubationszeit | Formulierung | Aktivitätsbeschreibung | PMID |
|---|---|---|---|---|---|---|
| P388 cells | Cytotoxicity assay | Cytotoxicity against murine P388 cells, IC50=0.05 μM | ||||
| human HSC2 | Cytotoxicity assay | Cytotoxicity against human HSC2 by MTT method, CC50=0.094 μM | ||||
| HL60 cells | Cytotoxicity assay | Cytotoxicity against human HL60 cells in presence of RPMI1640 containing 10% fetal bovine serum by trypan blue exclusion test, CC50=0.13 μM | ||||
| Molt 4/C8 cells | Cytotoxicity assay | Cytotoxicity against human Molt 4/C8 cells, IC50=0.15 μM | ||||
| CEM cells | Cytotoxicity assay | Cytotoxicity against human CEM cells, IC50=0.26 μM | ||||
| L1210 cells | Cytotoxicity assay | Cytotoxicity against murine L1210 cells, IC50=0.42 μM | ||||
| HSC4 cells | Cytotoxicity assay | Cytotoxicity against human HSC4 cells by MTT method, CC50=0.56 μM | ||||
| Klicken Sie hier, um weitere experimentelle Daten zu Zelllinien anzuzeigen | ||||||
Chemische Informationen, Lagerung & Stabilität
| Molekulargewicht | 419.39 | Formel | C22H17N3O6 |
Lagerung (Ab dem Eingangsdatum) | |
|---|---|---|---|---|---|
| CAS-Nr. | 1009817-63-3 | SDF herunterladen | Lagerung von Stammlösungen |
|
|
| Synonyme | NSC687852 | Smiles | C=CC(=O)N1CC(=CC2=CC=C(C=C2)[N+](=O)[O-])C(=O)C(=CC3=CC=C(C=C3)[N+](=O)[O-])C1 | ||
Löslichkeit
|
In vitro |
DMSO
: 48 mg/mL
(114.45 mM)
Water : Insoluble Ethanol : Insoluble |
Molaritätsrechner
|
In vivo |
|||||
In-vivo-Formulierungsrechner (Klare Lösung)
Schritt 1: Geben Sie die untenstehenden Informationen ein (Empfohlen: Ein zusätzliches Tier zur Berücksichtigung von Verlusten während des Experiments)
Schritt 2: Geben Sie die In-vivo-Formulierung ein (Dies ist nur der Rechner, keine Formulierung. Bitte kontaktieren Sie uns zuerst, wenn es im Abschnitt "Löslichkeit" keine In-vivo-Formulierung gibt.)
Berechnungsergebnisse:
Arbeitskonzentration: mg/ml;
Methode zur Herstellung der DMSO-Stammlösung: mg Wirkstoff vorgelöst in μL DMSO ( Konzentration der Stammlösung mg/mL, Bitte kontaktieren Sie uns zuerst, wenn die Konzentration die DMSO-Löslichkeit der Wirkstoffcharge überschreitet. )
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügenμL PEG300, mischen und klären, dann hinzufügenμL Tween 80, mischen und klären, dann hinzufügen μL ddH2O, mischen und klären.
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügen μL Maisöl, mischen und klären.
Hinweis: 1. Bitte stellen Sie sicher, dass die Flüssigkeit klar ist, bevor Sie das nächste Lösungsmittel hinzufügen.
2. Achten Sie darauf, das/die Lösungsmittel der Reihe nach hinzuzufügen. Sie müssen sicherstellen, dass die bei der vorherigen Zugabe erhaltene Lösung eine klare Lösung ist, bevor Sie mit der Zugabe des nächsten Lösungsmittels fortfahren. Physikalische Methoden wie Vortex, Ultraschall oder ein heißes Wasserbad können zur Unterstützung des Lösens verwendet werden.
Wirkmechanismus
| Merkmale |
Not a general deubiquitinase inhibitor. Has minimal inhibition on recombinant and cytosolic nonproteasomal cysteine deubiquitinases.
|
|---|---|
| Targets/IC50/Ki |
USP14
UCHL5
2.1 μM
|
| In vitro |
b-AP15 hemmt die Aktivität von zwei 19S-regulatorischen Partikel-assoziierten Deubiquitinasen, Ubiquitin-C-terminale Hydrolase 5 (UCHL5) und Ubiquitin-spezifische Peptidase 14 (USP14), was zur Akkumulation von Polyubiquitin führt. Diese Verbindung führt zu einer dosisabhängigen Akkumulation des UbG76V-YFP-Reporters mit einer IC50 von 0,8 μM, was eine beeinträchtigte Proteasom-Degradation anzeigt. Es (1 μM) führt zu einer schnellen Akkumulation von polyubiquitinierten Proteinen in menschlichen Darmkarzinom-HCT-116-Zellen. Diese Chemikalie (2,2 μM) erhöht die Mengen der Cyclin-abhängigen Kinasen CDKN1A und CDKNIB sowie des Tumorsuppressors TP53 in einer dosisabhängigen Weise, ohne die Mengen der Ornithindecarboxylase 1 (ODC1) in HCT-116-Zellen zu verändern. Es (1 μM) führt zu einem G2/M-Phasen-Zellzyklus-Arrest in HCT-116-Zellen, was mit der Akkumulation von Zellzyklus-Inhibitoren übereinstimmt. Diese Verbindung führt zu einer Erhöhung der Anzahl hypodiploider Zellen und ist mit erhöhten Mengen apoptotischer Marker verbunden, einschließlich aktivierter Caspase-3, Caspase-gespaltener Poly-ADP-Ribose-Polymerase (PARP) und Zytokeratin-18 (CK18). Es ist toxischer für HCT-116-Zellen im Vergleich zu immortalisierten Epithelzellen (hTERT-RPE1) oder peripheren Blutmononuklearzellen. Dieser Inhibitor hemmt die Deubiquitinierungsaktivität unter Verwendung einer Vielzahl von Substraten, einschließlich Ub-AMC, Ub-GFP22, ubiquitinierten p53-bindenden Protein-Homologs (HDM2) sowie K48- und K63-verknüpften Ubiquitin-Tetramerketten. Es ist ein Inhibitor des UPS, der den Zelltod über die Induktion des lysosomalen Apoptosewegs in einer Cathepsin-D-abhängigen Weise induzierte. Diese Verbindung ruft charakteristische UPS-Defekte hervor, einschließlich der Akkumulation von Ubiquitin-Konjugaten und Zellzyklus-Inhibitoren wie p21, p27 und dem Tumorsuppressor p53. Es hemmt die DUB-Aktivität beider Cystein-DUBs, wobei USP14 etwas empfindlicher ist als UCHL5. Diese Chemikalie induziert Apoptose in Zellen, die das anti-apoptotische Bcl-2-Protein überexprimieren, und in Zellen, denen das p53-Gen fehlt. Es (1 μM) hemmt die ATP-induzierte IL-1β-Freisetzung aus LPS-primierten Peritonealmakrophagen. Diese Verbindung (1 μM) reduziert die durch Nigericin-Behandlung in THP-1-Zellen induzierten Zelltoxizität. Es (1 μM) reduziert signifikant die Anzahl der ASC-Specks, die nach Nigericin-Behandlung in LPS-primierten THP-1-Zellen gebildet werden.
|
| In vivo |
b-AP15 (5 mg/kg) zeigt eine signifikante Antitumoraktivität bei SCID-Mäusen mit FaDu-Plattenepithelkarzinom-Xenotransplantaten. Diese Verbindung verzögert signifikant das Tumorwachstum bei Mäusen mit HCT-116-Kolonkarzinom-Xenotransplantaten.
|
Literatur |
|
Technischer Support
Tel: +1-832-582-8158 Ext:3
Wenn Sie weitere Fragen haben, hinterlassen Sie bitte eine Nachricht.
