nur für Forschungszwecke
Beta-Lapachone Topoisomerase Inhibitor
Kat.-Nr.S7261
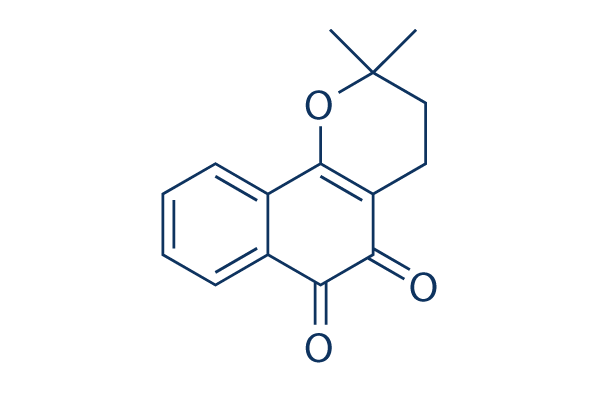
Chemische Struktur
Molekulargewicht: 242.27
Qualitätskontrolle
| Verwandte Ziele | HDAC PARP ATM/ATR DNA-PK WRN DNA/RNA Synthesis PPAR Sirtuin Casein Kinase eIF |
|---|---|
| Weitere Topoisomerase Inhibitoren | Camptothecin (CPT) Betulinic acid (S)-10-Hydroxycamptothecin Amonafide Voreloxin (SNS-595) hydrochloride Ellagic acid Cu(II)-Elesclomol Hydroxy Camptothecine Rubitecan Belotecan (CKD-602) hydrochloride |
Chemische Informationen, Lagerung & Stabilität
| Molekulargewicht | 242.27 | Formel | C15H14O3 |
Lagerung (Ab dem Eingangsdatum) | |
|---|---|---|---|---|---|
| CAS-Nr. | 4707-32-8 | SDF herunterladen | Lagerung von Stammlösungen |
|
|
| Synonyme | β-Lapachone, ARQ-501 | Smiles | CC1(CCC2=C(O1)C3=CC=CC=C3C(=O)C2=O)C | ||
Löslichkeit
|
In vitro |
DMSO
: 33 mg/mL
(136.21 mM)
Ethanol : 16 mg/mL Water : Insoluble |
Molaritätsrechner
|
In vivo |
|||||
In-vivo-Formulierungsrechner (Klare Lösung)
Schritt 1: Geben Sie die untenstehenden Informationen ein (Empfohlen: Ein zusätzliches Tier zur Berücksichtigung von Verlusten während des Experiments)
Schritt 2: Geben Sie die In-vivo-Formulierung ein (Dies ist nur der Rechner, keine Formulierung. Bitte kontaktieren Sie uns zuerst, wenn es im Abschnitt "Löslichkeit" keine In-vivo-Formulierung gibt.)
Berechnungsergebnisse:
Arbeitskonzentration: mg/ml;
Methode zur Herstellung der DMSO-Stammlösung: mg Wirkstoff vorgelöst in μL DMSO ( Konzentration der Stammlösung mg/mL, Bitte kontaktieren Sie uns zuerst, wenn die Konzentration die DMSO-Löslichkeit der Wirkstoffcharge überschreitet. )
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügenμL PEG300, mischen und klären, dann hinzufügenμL Tween 80, mischen und klären, dann hinzufügen μL ddH2O, mischen und klären.
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügen μL Maisöl, mischen und klären.
Hinweis: 1. Bitte stellen Sie sicher, dass die Flüssigkeit klar ist, bevor Sie das nächste Lösungsmittel hinzufügen.
2. Achten Sie darauf, das/die Lösungsmittel der Reihe nach hinzuzufügen. Sie müssen sicherstellen, dass die bei der vorherigen Zugabe erhaltene Lösung eine klare Lösung ist, bevor Sie mit der Zugabe des nächsten Lösungsmittels fortfahren. Physikalische Methoden wie Vortex, Ultraschall oder ein heißes Wasserbad können zur Unterstützung des Lösens verwendet werden.
Wirkmechanismus
| Targets/IC50/Ki |
Topo I
IDO1
0.44 μM
|
|---|---|
| In vitro |
Beta-Lapachone hemmt die durch DNA topoisomerase I induzierte DNA-Relaxation dosisabhängig. Die Behandlung mit dieser Verbindung (100 nM oder mehr) führt zu einer >95%igen Hemmung der Topo I DNA-Entwindungsaktivität im Vergleich zur DMSO-Kontrolle. Diese Chemikalie (1-5 μM) verursacht eine Blockade in G0/G1 des Zellzyklus und induziert Apoptose, indem sie Topo I an die DNA bindet und die Bewegung der Replikationsgabel in HL-60- und drei menschlichen Prostatakrebszellen (DU-145, PC-3 und LNCaP) blockiert. Es fördert die Migration von Maus-3T3-Fibroblasten und menschlichen endothelialen EAhy926-Zellen über verschiedene MAPK-Signalwege und beschleunigt so die Wundheilung in vitro. Darüber hinaus hemmt diese Verbindung die gereinigte rekombinante IDO1-Aktivität durch unkompetitive Hemmung mit einer IC50 von 0,44 μM, und sie zeigt auch eine überlegene Retention der intrazellulären IDO1-Inhibitionsaktivität mit einer IC50 von 1,0 μM, teilweise abhängig von der Biotransformation durch NQO1. Diese Chemikalie induziert die programmierte Nekrose von NQO1+ Krebszellen durch NQO1-abhängige Bildung reaktiver Sauerstoffspezies (ROS) und PARP1-Hyperaktivierung. [5]
|
| Kinase-Assay |
Topoisomerase I Katalytischer Aktivitätstest
|
|
Topoisomerase I Katalytischer Aktivitätstest: Die enzymatische Aktivität wird durch den DNA-Entwindungstest analysiert. DNA topoisomerase I von TopoGEN (1 Einheit, die als die Enzymmenge definiert ist, die 0,5 μg superhelikaler DNA in 30 Minuten bei 37 °C in den entspannten Zustand umwandelt) wird mit 0,5 μg 6x174 RF DNA, in Gegenwart oder Abwesenheit von Beta-Lapachone, in 20 μL Relaxationspuffer (50 mM Tris (pH 7,5), 50 mM KCI, 10 mM MgCl2, 0,5 mM Dithiothreitol, 0,5 mM EDTA, 30 μg/mL Rinderserumalbumin) für 30 Minuten bei 37 °C inkubiert. Die Reaktionen werden durch Zugabe von 1% SDS und Proteinase K (50 μg/mL) gestoppt. Nach einer weiteren 1-stündigen Inkubation bei 37 °C werden die Produkte durch Elektrophorese in 1% Agarosegel in TAE-Puffer (0,04 M Trisacetat, 0,001 M EDTA) getrennt. Das Gel wird nach der Elektrophorese mit Ethidiumbromid gefärbt. Das fotografische Negativ wird mit einem NIH-Bildanalyse-System gescannt.
|
|
| In vivo |
Beta-Lapachone-Behandlung (50 mg/kg) führt zu einer potenten Hemmung des in-vivo-Tumorwachstums in einem Xenograft-Mausmodell des menschlichen Ovarialkarzinoms, und die Kombination dieser Verbindung mit Taxol erzeugt eine synergistische Induktion der Apoptose. Bei normalen und diabetischen (db/db) Mäusen führt die Behandlung mit dieser Chemikalie zu einem schnelleren Heilungsprozess als nur das Vehikel.
|
Literatur |
|
Klinische Studieninformationen
(Daten von https://clinicaltrials.gov, aktualisiert am 2024-05-22)
| NCT-Nummer | Rekrutierung | Erkrankungen | Sponsor/Kooperationspartner | Startdatum | Phasen |
|---|---|---|---|---|---|
| NCT00524524 | Completed | Advanced Solid Tumors |
ArQule Inc. a subsidiary of Merck Sharp & Dohme LLC a subsidiary of Merck & Co. Inc. (Rahway NJ USA) |
August 2007 | Phase 1 |
| NCT00622063 | Completed | Cancer |
ArQule Inc. a subsidiary of Merck Sharp & Dohme LLC a subsidiary of Merck & Co. Inc. (Rahway NJ USA) |
December 2006 | Phase 1|Phase 2 |
| NCT00358930 | Completed | Head and Neck Neoplasms|Carcinoma Squamous Cell |
ArQule Inc. a subsidiary of Merck Sharp & Dohme LLC a subsidiary of Merck & Co. Inc. (Rahway NJ USA) |
July 2006 | Phase 2 |
| NCT00102700 | Completed | Pancreatic Cancer|Adenocarcinoma |
ArQule Inc. a subsidiary of Merck Sharp & Dohme LLC a subsidiary of Merck & Co. Inc. (Rahway NJ USA) |
January 2005 | Phase 2 |
| NCT00099190 | Completed | Carcinoma |
ArQule Inc. a subsidiary of Merck Sharp & Dohme LLC a subsidiary of Merck & Co. Inc. (Rahway NJ USA) |
December 2004 | Phase 1 |
Technischer Support
Tel: +1-832-582-8158 Ext:3
Wenn Sie weitere Fragen haben, hinterlassen Sie bitte eine Nachricht.
