nur für Forschungszwecke
Bexarotene Retinoid Receptor Agonist
Kat.-Nr.S2098
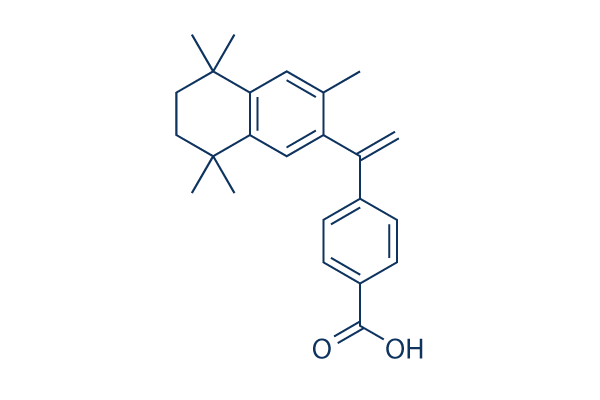
Chemische Struktur
Molekulargewicht: 348
Qualitätskontrolle
| Verwandte Ziele | Dehydrogenase HSP Transferase P450 (e.g. CYP17) PDE phosphatase PPAR Vitamin Carbohydrate Metabolism Mitochondrial Metabolism |
|---|---|
| Weitere Retinoid Receptor Inhibitoren | TTNPB (Arotinoid acid) Tamibarotene AM580 Fenretinide UVI 3003 SR 11237 AR7 BMS493 All trans-Retinal MSU-42011 |
Chemische Informationen, Lagerung & Stabilität
| Molekulargewicht | 348 | Formel | C24H28O2 |
Lagerung (Ab dem Eingangsdatum) | |
|---|---|---|---|---|---|
| CAS-Nr. | 153559-49-0 | SDF herunterladen | Lagerung von Stammlösungen |
|
|
| Synonyme | LGD1069 | Smiles | CC1=CC2=C(C=C1C(=C)C3=CC=C(C=C3)C(=O)O)C(CCC2(C)C)(C)C | ||
Löslichkeit
|
In vitro |
DMSO
: 70 mg/mL
(201.14 mM)
Water : Insoluble Ethanol : Insoluble |
Molaritätsrechner
|
In vivo |
|||||
In-vivo-Formulierungsrechner (Klare Lösung)
Schritt 1: Geben Sie die untenstehenden Informationen ein (Empfohlen: Ein zusätzliches Tier zur Berücksichtigung von Verlusten während des Experiments)
Schritt 2: Geben Sie die In-vivo-Formulierung ein (Dies ist nur der Rechner, keine Formulierung. Bitte kontaktieren Sie uns zuerst, wenn es im Abschnitt "Löslichkeit" keine In-vivo-Formulierung gibt.)
Berechnungsergebnisse:
Arbeitskonzentration: mg/ml;
Methode zur Herstellung der DMSO-Stammlösung: mg Wirkstoff vorgelöst in μL DMSO ( Konzentration der Stammlösung mg/mL, Bitte kontaktieren Sie uns zuerst, wenn die Konzentration die DMSO-Löslichkeit der Wirkstoffcharge überschreitet. )
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügenμL PEG300, mischen und klären, dann hinzufügenμL Tween 80, mischen und klären, dann hinzufügen μL ddH2O, mischen und klären.
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügen μL Maisöl, mischen und klären.
Hinweis: 1. Bitte stellen Sie sicher, dass die Flüssigkeit klar ist, bevor Sie das nächste Lösungsmittel hinzufügen.
2. Achten Sie darauf, das/die Lösungsmittel der Reihe nach hinzuzufügen. Sie müssen sicherstellen, dass die bei der vorherigen Zugabe erhaltene Lösung eine klare Lösung ist, bevor Sie mit der Zugabe des nächsten Lösungsmittels fortfahren. Physikalische Methoden wie Vortex, Ultraschall oder ein heißes Wasserbad können zur Unterstützung des Lösens verwendet werden.
Wirkmechanismus
| Targets/IC50/Ki |
RXR
|
|---|---|
| In vitro |
Die Behandlung mit Bexarotene bei 1 mM und 10 mM für 96 h erhöht die Anzahl der Zellen mit Sub-G1-Populationen und Annexin-V-Bindung dosisabhängig im Vergleich zu Vehikelkontrollen (DMSO) in etablierten CTCL-Zelllinien (MJ, Hut78 und HH) bzw. Diese Verbindung unterdrückt die Expression von retinoid X receptor alpha- und Retinoic acid receptor alpha-Proteinen in allen drei Linien im Vergleich zu unbehandelten Kontrollen. Es verringert die Proteinspiegel von Survivin, aktiviert Caspase-3 und gespaltene Poly(ADP-Ribose)-Polymerase, hat aber keine offensichtliche Wirkung auf die Expression von Fas/Fas-Ligand- und bcl-2-Proteinen in allen drei CTCL-Linien. Es induziert einen Verlust der Lebensfähigkeit und eine ausgeprägtere Hemmung der klonogenen Proliferation in HH- und Hut-78-Zellen, während die MJ-Linie Resistenz aufweist. Die Chemikalie reguliert Bax in empfindlichen Linien hoch und aktiviert es, obwohl dies nicht ausreicht, um eine signifikante Apoptose zu signalisieren. Es signalisiert sowohl einen G(1)- als auch einen G(2)/M-Arrest durch die Modulation kritischer Checkpoint-Proteine. Es aktiviert p53 durch Phosphorylierung an Ser15, was die Bindung von p53 an Promotoren für den Zellzyklusarrest beeinflusst, induziert die p73-Hochregulierung und moduliert dementsprechend auch einige p53/p73-nachgeschaltete Zielgene, wie p21, Bax, Survivin und cdc2.
|
| In vivo |
Bexarotene verhindert signifikant die ER-negative Mamma-Tumorentstehung mit geringerer Toxizität als natürlich vorkommende Retinoide in Tiermodellen. Diese Verbindung hemmt die Entwicklung präinvasiver Mammarläsionen wie Hyperplasien und Carcinoma-in-situ bei MMTV-erbB2-Mäusen.
|
Literatur |
|
Klinische Studieninformationen
(Daten von https://clinicaltrials.gov, aktualisiert am 2024-05-22)
| NCT-Nummer | Rekrutierung | Erkrankungen | Sponsor/Kooperationspartner | Startdatum | Phasen |
|---|---|---|---|---|---|
| NCT03323658 | Completed | Breast Atypical Ductal Hyperplasia|Breast Atypical Lobular Hyperplasia|Breast Ductal Carcinoma In Situ|Breast Lobular Carcinoma In Situ|Invasive Breast Carcinoma |
National Cancer Institute (NCI) |
June 15 2018 | Phase 1 |
| NCT01569724 | Completed | Hypertriglyceridemia|Cutaneous T Cell Lymphoma |
Rennes University Hospital |
January 2012 | Phase 4 |
| NCT01001143 | Completed | Leukemia Myeloid Acute |
Washington University School of Medicine |
May 2010 | Phase 1 |
| NCT00615784 | Terminated | Acute Myeloid Leukemia |
Abramson Cancer Center at Penn Medicine |
May 25 2010 | Phase 2 |
| NCT00125372 | Completed | Carcinoma Non-small-cell Lung |
Dartmouth-Hitchcock Medical Center|Ligand Pharmaceuticals|Genentech Inc. |
December 2005 | Not Applicable |
| NCT00316030 | Completed | AML|Acute Myeloid Leukemia |
Abramson Cancer Center at Penn Medicine |
January 2004 | Phase 1 |
Technischer Support
Tel: +1-832-582-8158 Ext:3
Wenn Sie weitere Fragen haben, hinterlassen Sie bitte eine Nachricht.
