nur für Forschungszwecke
PMSF Serine Protease Inhibitor
Kat.-Nr.S3025
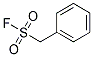
Chemische Struktur
Molekulargewicht: 174.19
Qualitätskontrolle
| Verwandte Ziele | HDAC Caspase Proteasome Secretase MMP HCV Protease Cysteine Protease DPP Tyrosinase HIV Protease |
|---|---|
| Weitere Serine Protease Inhibitoren | Leupeptin Hemisulfate Nafamostat mesilate (FUT-175) Sivelestat AEBSF HCl Gabexate Mesylate Alvelestat (AZD9668) Sivelestat sodium tetrahydrate UK-371804 HCl Fulacimstat ZK824859 |
Chemische Informationen, Lagerung & Stabilität
| Molekulargewicht | 174.19 | Formel | C7H7FO2S |
Lagerung (Ab dem Eingangsdatum) | |
|---|---|---|---|---|---|
| CAS-Nr. | 329-98-6 | SDF herunterladen | Lagerung von Stammlösungen |
|
|
| Synonyme | Phenylmethylsulfonyl Fluoride, Benzylsulfonyl fluoride | Smiles | C1=CC=C(C=C1)CS(=O)(=O)F | ||
Löslichkeit
|
In vitro |
DMSO
: 35 mg/mL
(200.93 mM)
Ethanol : 35 mg/mL Water : Insoluble |
Molaritätsrechner
|
In vivo |
|||||
In-vivo-Formulierungsrechner (Klare Lösung)
Schritt 1: Geben Sie die untenstehenden Informationen ein (Empfohlen: Ein zusätzliches Tier zur Berücksichtigung von Verlusten während des Experiments)
Schritt 2: Geben Sie die In-vivo-Formulierung ein (Dies ist nur der Rechner, keine Formulierung. Bitte kontaktieren Sie uns zuerst, wenn es im Abschnitt "Löslichkeit" keine In-vivo-Formulierung gibt.)
Berechnungsergebnisse:
Arbeitskonzentration: mg/ml;
Methode zur Herstellung der DMSO-Stammlösung: mg Wirkstoff vorgelöst in μL DMSO ( Konzentration der Stammlösung mg/mL, Bitte kontaktieren Sie uns zuerst, wenn die Konzentration die DMSO-Löslichkeit der Wirkstoffcharge überschreitet. )
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügenμL PEG300, mischen und klären, dann hinzufügenμL Tween 80, mischen und klären, dann hinzufügen μL ddH2O, mischen und klären.
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügen μL Maisöl, mischen und klären.
Hinweis: 1. Bitte stellen Sie sicher, dass die Flüssigkeit klar ist, bevor Sie das nächste Lösungsmittel hinzufügen.
2. Achten Sie darauf, das/die Lösungsmittel der Reihe nach hinzuzufügen. Sie müssen sicherstellen, dass die bei der vorherigen Zugabe erhaltene Lösung eine klare Lösung ist, bevor Sie mit der Zugabe des nächsten Lösungsmittels fortfahren. Physikalische Methoden wie Vortex, Ultraschall oder ein heißes Wasserbad können zur Unterstützung des Lösens verwendet werden.
Wirkmechanismus
| Targets/IC50/Ki |
cysteine protease
chymotrypsin
|
|---|---|
| In vitro |
Obwohl menschlicher Trypsin weniger anfällig für die Hemmung durch PMSF ist, inaktiviert diese Verbindung gereinigtes Chymotrypsin aus der menschlichen Bauchspeicheldrüse schnell. Es hemmt auch schnell Acetylcholinesterase aus menschlichen roten Blutkörperchen. Als Inhibitor der Phosphatidylinositol-spezifischen Phospholipase C hemmt die Behandlung mit dieser Chemikalie bei 2 mM die Carbachol-stimulierte Inositol-Inkorporation in Phosphatidylinositol (PI) der longitudinalen glatten Muskulatur des Meerschweinchenileums fast vollständig, während sie keinen Einfluss auf die Kalium-stimulierte Inositol-Inkorporation hat. Im Gegensatz zu seiner spezifischen Hemmung des Carbachol-stimulierten Phosphoinositid-Umsatzes bewirkt dieser Wirkstoff eine vorübergehende Hemmung der Kontraktion durch sowohl Carbachol als auch Kalium. Es wurde gezeigt, dass es die Addition von Ethanolaminphosphat zu Glykosylphosphatidylinositol (GPI)-Intermediaten in Trypanosoma brucei hemmt. Dieser Inhibitor hemmt auch die Acylierung des Inositolrests von GPI-Intermediaten in der Blutstromform von T. brucei. Er hemmt die Ethanolaminphosphat-Addition und die Inositol-Acylierung für prozyklische Formen von T. brucei, jedoch nicht für Säugetier-HeLa-Zellen. Diese Verbindung ist der reaktivere Inaktivator der Maus-Acetylcholinesterase (AChE), da die 8-fach höhere BSF-Konzentration erforderlich ist, um selbst eine 6-fach langsamere Inaktivierung als die mit PMSF zu erreichen.
|
| In vivo |
Die intraperitoneale Injektion von PMSF erzeugt eine dosisabhängige Analgesie bei Sprague-Dawley-Ratten. Diese Verbindung verstärkt signifikant die analgetische Wirkung von Beta-Endorphin (END) bei Ratten. Mäuse, die i.p. Injektionen dieser Chemikalie erhielten, zeigen Cannabinoid-Effekte, die Antinozizeption, Hypothermie und Immobilität mit ED50 von 86 mg/kg, 224 mg/kg bzw. 206 mg/kg umfassen. Die Vorbehandlung mit einer inaktiven Dosis dieser Verbindung (30 mg/kg) verstärkt die Wirkungen von Anandamid auf die Schwanzzuckreaktion (Antinozizeption), die spontane Aktivität und die Mobilität um das 5-, 10- bzw. 8-fache. Die Verabreichung dieser Chemikalie 12 Stunden vor PSP bewirkt einen vollständigen Schutz bei Organophosphorester-induzierter verzögerter Neuropathie (OPIDN) bei Hühnern, aber wenn sie 4 Stunden nach PSP verabreicht wird, verstärkt sie ihre neurotoxischen Effekte. Die Vorbehandlung mit dieser Verbindung (30 mg/kg, i.p.) vor einer Injektion von 1 oder 10 mg/kg 3H-Anandamid führt 5 Minuten später zu erhöhten Gehirnkonzentrationen von Anandamid im Vergleich zu denen, die mit 3H-Anandamid plus Vehikelinjektion erzielt wurden. Die Vorbehandlung damit hemmt den durch Tri-ortho-cresylphosphat (TOCP) induzierten Neurofilament (NF)-Abbau und schützt Hühner vor der Entwicklung einer Organophosphat-induzierten verzögerten Neuropathie (OPIDN). Die Verabreichung dieser Chemikalie verstärkt die charakteristischen cannabimimetischen Effekte von Δ(9)-Tetrahydrocannabinol (THC) oder Anandamid (AEA) bei ICR-Mäusen, indem sie das Enzym Fettsäureamidhydrolase hemmt.
|
Literatur |
|
Klinische Studieninformationen
(Daten von https://clinicaltrials.gov, aktualisiert am 2024-05-22)
| NCT-Nummer | Rekrutierung | Erkrankungen | Sponsor/Kooperationspartner | Startdatum | Phasen |
|---|---|---|---|---|---|
| NCT04062786 | Unknown status | Scheduled Heart Surgery|Valve Replacement|Coronary Artery Bypass |
University Hospital Strasbourg France |
February 21 2019 | -- |
| NCT03300323 | Unknown status | Peri-operative Fluid Management |
St George''s Healthcare NHS Trust |
October 2017 | Not Applicable |
| NCT02569008 | Completed | Post Cardiac Surgery |
St George''s University of London |
January 2014 | Not Applicable |
Technischer Support
Tel: +1-832-582-8158 Ext:3
Wenn Sie weitere Fragen haben, hinterlassen Sie bitte eine Nachricht.
