nur für Forschungszwecke
Quinolinic acid NMDAR Agonist
Kat.-Nr.S3624
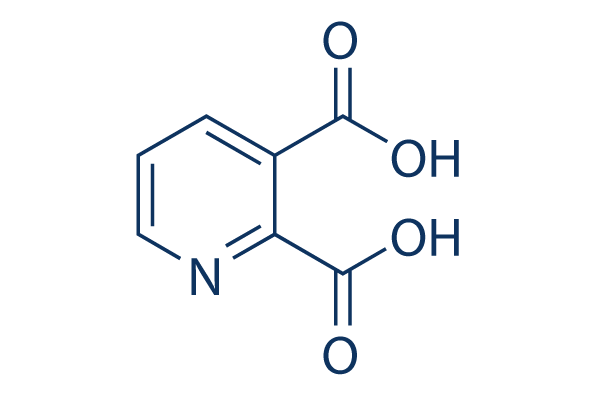
Chemische Struktur
Molekulargewicht: 167.12
Qualitätskontrolle
- In Nature Medicine für seine erstklassige Qualität zitiert
- COA
- HPLC
- SDS
- Datenblatt
Chemische Informationen, Lagerung & Stabilität
| Molekulargewicht | 167.12 | Formel | C7H5NO4 |
Lagerung (Ab dem Eingangsdatum) | |
|---|---|---|---|---|---|
| CAS-Nr. | 89-00-9 | SDF herunterladen | Lagerung von Stammlösungen |
|
|
| Synonyme | pyridine-2,3-dicarboxylic acid, QUIN | Smiles | C1=CC(=C(N=C1)C(=O)O)C(=O)O | ||
Löslichkeit
|
In vitro |
DMSO
: 25 mg/mL
(149.59 mM)
Water : 3 mg/mL Ethanol : Insoluble |
Molaritätsrechner
|
In vivo |
|||||
In-vivo-Formulierungsrechner (Klare Lösung)
Schritt 1: Geben Sie die untenstehenden Informationen ein (Empfohlen: Ein zusätzliches Tier zur Berücksichtigung von Verlusten während des Experiments)
Schritt 2: Geben Sie die In-vivo-Formulierung ein (Dies ist nur der Rechner, keine Formulierung. Bitte kontaktieren Sie uns zuerst, wenn es im Abschnitt "Löslichkeit" keine In-vivo-Formulierung gibt.)
Berechnungsergebnisse:
Arbeitskonzentration: mg/ml;
Methode zur Herstellung der DMSO-Stammlösung: mg Wirkstoff vorgelöst in μL DMSO ( Konzentration der Stammlösung mg/mL, Bitte kontaktieren Sie uns zuerst, wenn die Konzentration die DMSO-Löslichkeit der Wirkstoffcharge überschreitet. )
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügenμL PEG300, mischen und klären, dann hinzufügenμL Tween 80, mischen und klären, dann hinzufügen μL ddH2O, mischen und klären.
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügen μL Maisöl, mischen und klären.
Hinweis: 1. Bitte stellen Sie sicher, dass die Flüssigkeit klar ist, bevor Sie das nächste Lösungsmittel hinzufügen.
2. Achten Sie darauf, das/die Lösungsmittel der Reihe nach hinzuzufügen. Sie müssen sicherstellen, dass die bei der vorherigen Zugabe erhaltene Lösung eine klare Lösung ist, bevor Sie mit der Zugabe des nächsten Lösungsmittels fortfahren. Physikalische Methoden wie Vortex, Ultraschall oder ein heißes Wasserbad können zur Unterstützung des Lösens verwendet werden.
Wirkmechanismus
| Targets/IC50/Ki |
NMDAR
|
|---|---|
| In vitro |
QUIN ist ein Agonist des N-Methyl-D-Aspartat (NMDA)-Rezeptors und besitzt eine hohe In-vivo-Potenz als Exzitotoxin. Obwohl QUIN über ein Aufnahmesystem verfügt, wird sein neuronales Abbauenzym schnell gesättigt, und der Rest des extrazellulären QUIN kann den NMDA-Rezeptor weiterhin stimulieren. QUIN (10 μM) verhindert die Glutamat-induzierte Exzitotoxizität in primären Kulturen von Ratten-Kleinhirngranulaneuronen; dennoch zeigen reife organotypische Kulturen des Ratten-Kortikostriatal-Systems oder Nucleus caudatus, die chronisch 100 nM QUIN über bis zu 7 Wochen ausgesetzt waren, eine fokale Degeneration, gekennzeichnet durch das Vorhandensein von Vakuolen im Neuropil, geschwollenen Dendriten, gelegentlich geschwollenen postsynaptischen Elementen und degenerierten Neuronen. In-vitro-QUIN-Behandlung von primären menschlichen fötalen Neuronen führt zu einem substanziellen Anstieg der Tau-Phosphorylierung an mehreren Positionen. Der Anstieg der QUIN-induzierten Phosphorylierung von Tau wird auf eine Abnahme der Expression und Aktivität der wichtigsten Tau-Phosphatasen zurückgeführt. QUIN kann die B-Monoaminoxidase (MAO-B) in synaptosomalen Mitochondrien des menschlichen Gehirns hemmen und ist auch ein potenter Inhibitor der Phosphoenolpyruvat-Carboxykinase (EC 4.1.1.32) aus dem Zytoplasma der Rattenleber, einem wichtigen Enzym im Glukoneogeneseweg, das Oxalacetat zu Phosphoenolpyruvat umwandelt. QUIN kann die Produktion freier Radikale erhöhen, indem es die NOS-Aktivität in Astrozyten und Neuronen induziert, was zu oxidativem Stress führt, sowohl die Poly(ADP-Ribose)-Polymerase (PARP)-Aktivität als auch die extrazelluläre Laktatdehydrogenase (LDH)-Aktivität erhöht.
|
| In vivo |
Chinolininsäure (QUIN), ein neuroaktiver Metabolit des Kynurenin-Stoffwechselwegs, ist normalerweise in nanomolaren Konzentrationen im menschlichen Gehirn und in der Zerebrospinalflüssigkeit (CSF) vorhanden und wird oft in die Pathogenese einer Vielzahl menschlicher neurologischer Erkrankungen verwickelt. Die Konzentration von QUIN variiert zwischen verschiedenen Hirnregionen, wobei der zerebrale Kortex ungefähr 1,8 nmol/g Nassgewicht enthält; fast 2-mal mehr als im Hippocampus (1 nmol/g Nassgewicht). Intraarterielle Verabreichung von mikromolaren oder millimolaren QUIN-Konzentrationen führt nur zu vernachlässigbaren Anreicherungen dieses Metaboliten im Gehirn, was darauf hindeutet, dass das zentrale Nervensystem (ZNS) durch die Blut-Hirn-Schranke (BBB) gut vor peripherem QUIN geschützt zu sein scheint. QUIN kann auch die Glutamatfreisetzung erhöhen und dessen Wiederaufnahme durch Astrozyten hemmen, wodurch dessen Konzentration in den Mikroenvironments steigt, Neurotoxizität verursacht und auch das Recycling von Glutamat zu Glutamin in Astrozyten durch Verringerung der Glutamin-Synthetase-Aktivität begrenzt wird. Intrastriatale Injektion von QUIN provoziert eine Abnahme der Zellatmung und der ATP-Spiegel.
|
Literatur |
|
Klinische Studieninformationen
(Daten von https://clinicaltrials.gov, aktualisiert am 2024-05-22)
| NCT-Nummer | Rekrutierung | Erkrankungen | Sponsor/Kooperationspartner | Startdatum | Phasen |
|---|---|---|---|---|---|
| NCT05513807 | Not yet recruiting | Delayed Graft Function |
Assistance Publique - Hôpitaux de Paris|Institut National de la Santé Et de la Recherche Médicale France|Centre National de la Recherche Scientifique France |
November 2022 | Phase 3 |
| NCT05718310 | Recruiting | Migraine|Migraine Disorders|Pain |
IRCCS National Neurological Institute C. Mondino Foundation|University of Pavia |
November 1 2022 | Not Applicable |
| NCT05969990 | Recruiting | Migraine in Children |
Qilu Hospital of Shandong University |
January 1 2022 | -- |
| NCT04342975 | Completed | AKI |
Mayo Clinic|Elysium Health |
December 1 2020 | Phase 2 |
Technischer Support
Tel: +1-832-582-8158 Ext:3
Wenn Sie weitere Fragen haben, hinterlassen Sie bitte eine Nachricht.
