nur für Forschungszwecke
PP121 PDGFR Inhibitor
Kat.-Nr.S2622
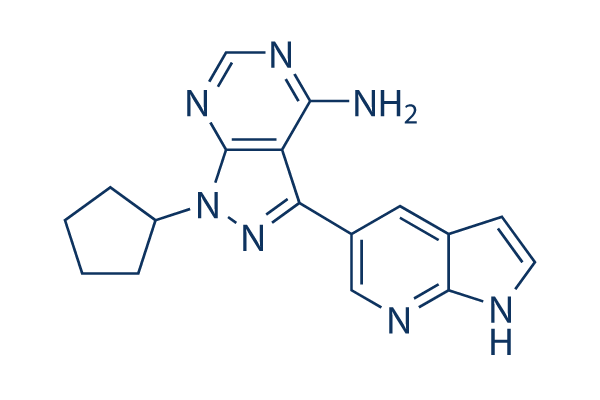
Chemische Struktur
Molekulargewicht: 319.36
Qualitätskontrolle
- In Nature Medicine für seine erstklassige Qualität zitiert
- COA
- NMR
- HPLC
- SDS
- Datenblatt
| Verwandte Ziele | EGFR VEGFR FGFR c-Met Src MEK CSF-1R FLT3 HER2 c-Kit |
|---|---|
| Weitere PDGFR Inhibitoren | CP-673451 Orantinib (SU6668) Tyrphostin AG 1296 Trapidil AZD2932 Sennoside B Tyrphostin AG1433 Seralutinib (GB002) N-(p-Coumaroyl) Serotonin JNJ-10198409 |
Chemische Informationen, Lagerung & Stabilität
| Molekulargewicht | 319.36 | Formel | C17H17N7 |
Lagerung (Ab dem Eingangsdatum) | |
|---|---|---|---|---|---|
| CAS-Nr. | 1092788-83-4 | SDF herunterladen | Lagerung von Stammlösungen |
|
|
| Synonyme | N/A | Smiles | C1CCC(C1)N2C3=NC=NC(=C3C(=N2)C4=CN=C5C(=C4)C=CN5)N | ||
Löslichkeit
|
In vitro |
DMSO
: 32 mg/mL
(100.2 mM)
Ultraschallbehandelt;
Water : Insoluble Ethanol : Insoluble |
Molaritätsrechner
|
In vivo |
|||||
In-vivo-Formulierungsrechner (Klare Lösung)
Schritt 1: Geben Sie die untenstehenden Informationen ein (Empfohlen: Ein zusätzliches Tier zur Berücksichtigung von Verlusten während des Experiments)
Schritt 2: Geben Sie die In-vivo-Formulierung ein (Dies ist nur der Rechner, keine Formulierung. Bitte kontaktieren Sie uns zuerst, wenn es im Abschnitt "Löslichkeit" keine In-vivo-Formulierung gibt.)
Berechnungsergebnisse:
Arbeitskonzentration: mg/ml;
Methode zur Herstellung der DMSO-Stammlösung: mg Wirkstoff vorgelöst in μL DMSO ( Konzentration der Stammlösung mg/mL, Bitte kontaktieren Sie uns zuerst, wenn die Konzentration die DMSO-Löslichkeit der Wirkstoffcharge überschreitet. )
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügenμL PEG300, mischen und klären, dann hinzufügenμL Tween 80, mischen und klären, dann hinzufügen μL ddH2O, mischen und klären.
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügen μL Maisöl, mischen und klären.
Hinweis: 1. Bitte stellen Sie sicher, dass die Flüssigkeit klar ist, bevor Sie das nächste Lösungsmittel hinzufügen.
2. Achten Sie darauf, das/die Lösungsmittel der Reihe nach hinzuzufügen. Sie müssen sicherstellen, dass die bei der vorherigen Zugabe erhaltene Lösung eine klare Lösung ist, bevor Sie mit der Zugabe des nächsten Lösungsmittels fortfahren. Physikalische Methoden wie Vortex, Ultraschall oder ein heißes Wasserbad können zur Unterstützung des Lösens verwendet werden.
Wirkmechanismus
| Targets/IC50/Ki |
PDGFR
2 nM
Hck
8 nM
VEGFR2
12 nM
mTOR
13 nM
Src
14 nM
Abl
18 nM
p110α
52 nM
DNA-PK
60 nM
p110δ
150 nM
EphB4
190 nM
|
|---|---|
| In vitro |
PP121 interagiert selektiv in einer hydrophoben Tasche, die sowohl bei Tyrosinkinasen als auch bei PI3Ks konserviert ist, nicht bei Serin-Threonin-Kinasen. PP121 bildet eine Wasserstoffbrücke zu Glu310 in Src, wodurch die strukturelle Rolle des katalytischen Lysins effektiv ersetzt wird und eine Anordnung der Helix C sowie eine Stabilisierung einer aktiven Konformation resultieren. PP121 hemmt auch andere PI3Ks, einschließlich p110α und DNA-PK, mit IC50-Werten von 52 nM bzw. 60 nM. PP121 blockiert potent und dosisabhängig die Phosphorylierung von Akt, p70S6K und S6 in zwei Glioblastom-Zelllinien, U87 und LN229. PP121 hemmt potent die Proliferation einer Untergruppe von Tumorzelllinien durch direkte Hemmung von PI3Ks und mTOR. PP121 induziert einen G0/G1-Arrest in LN220-, U87- und Seg1-Zellen. PP121 blockiert auch die durch v-Src induzierte Tyrosin-Phosphorylierung in NIH3T3-Zellen, die mit v-Src(Thr338) transformiert sind. PP121 konnte die Aktin-Stressfaserfärbung in NIH3T3-Zellen, die mit v-Src(Thr338) transformiert waren, wiederherstellen. PP121 hemmt bei einer geringen Konzentration von 40 nM die Ret-Autophosphorylierung in TT-Schilddrüsenkarzinomzellen, die die onkogene Ret-Mutante C634W35 exprimieren. PP121 hemmt die Zellproliferation mit einem IC50-Wert von 50 nM in TT-Schilddrüsenkarzinomzellen. PP121 hemmt die Zellproliferation, die nur mit VEGF stimuliert wurde, mit einem IC50-Wert von 41 nM in humanen umbilicalen Venenendothelzellen (HUVECs). PP121 hemmt direkt die durch Bcr-Abl induzierte Tyrosin-Phosphorylierung, was zu einer medikamenteninduzierten Apoptose in K562-Zellen und einer Kombination aus Apoptose und Zellzyklusarrest in Bcr-Abl-exprimierenden BaF3-Zellen führt. |
| Kinase-Assay |
Kinase-Assays
|
|
Gereinigte Kinasedomänen werden mit PP121 in 2- oder 4-facher Verdünnung über einen Konzentrationsbereich von 1 nM–50 µM oder mit Vehikel (0,1 % DMSO) in Anwesenheit von 10 µM ATP, 2,5 µCi γ-32P-ATP und Substrat inkubiert. Die Reaktionen werden durch Auftragen auf Nitrocellulose- oder Phosphocellulosemembranen, je nach Substrat, beendet; diese Membran wird dann 5–6 Mal gewaschen, um ungebundene Radioaktivität zu entfernen, und getrocknet. Die übertragene Radioaktivität wird mittels Phosphorimaging quantifiziert und die IC50-Werte werden durch Anpassen der Daten an eine sigmoide Dosis-Wirkungs-Kurve unter Verwendung der Prism-Software berechnet.
|
Literatur |
Technischer Support
Tel: +1-832-582-8158 Ext:3
Wenn Sie weitere Fragen haben, hinterlassen Sie bitte eine Nachricht.
