nur für Forschungszwecke
AZD2858 GSK-3 Inhibitor
Kat.-Nr.S7253
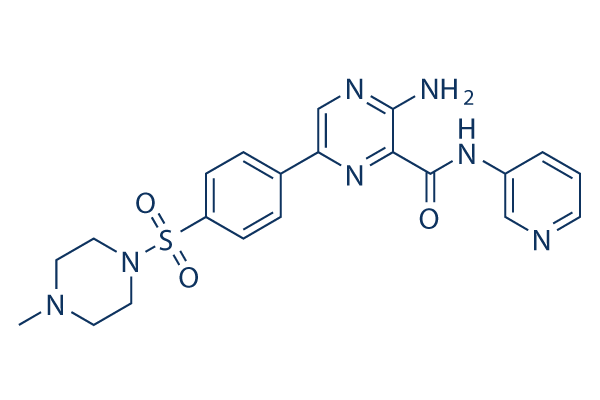
Chemische Struktur
Molekulargewicht: 453.52
Qualitätskontrolle
- In Nature Medicine für seine erstklassige Qualität zitiert
- COA
- NMR
- SDS
- Datenblatt
| Verwandte Ziele | PI3K Akt mTOR ATM/ATR DNA-PK AMPK PDPK1 PTEN PP2A PDK |
|---|---|
| Weitere GSK-3 Inhibitoren | CHIR-99021 (Laduviglusib) Laduviglusib (CHIR-99021) Hydrochloride SB216763 CHIR-98014 TWS119 GSK-3 Inhibitor IX (BIO) LY2090314 Tideglusib SB415286 AR-A014418 |
Chemische Informationen, Lagerung & Stabilität
| Molekulargewicht | 453.52 | Formel | C21H23N7O3S |
Lagerung (Ab dem Eingangsdatum) | |
|---|---|---|---|---|---|
| CAS-Nr. | 486424-20-8 | SDF herunterladen | Lagerung von Stammlösungen |
|
|
| Synonyme | N/A | Smiles | CN1CCN(CC1)S(=O)(=O)C2=CC=C(C=C2)C3=CN=C(C(=N3)C(=O)NC4=CN=CC=C4)N | ||
Löslichkeit
|
In vitro |
DMSO
: 7 mg/mL
(15.43 mM)
Water : Insoluble Ethanol : Insoluble |
Molaritätsrechner
|
In vivo |
|||||
In-vivo-Formulierungsrechner (Klare Lösung)
Schritt 1: Geben Sie die untenstehenden Informationen ein (Empfohlen: Ein zusätzliches Tier zur Berücksichtigung von Verlusten während des Experiments)
Schritt 2: Geben Sie die In-vivo-Formulierung ein (Dies ist nur der Rechner, keine Formulierung. Bitte kontaktieren Sie uns zuerst, wenn es im Abschnitt "Löslichkeit" keine In-vivo-Formulierung gibt.)
Berechnungsergebnisse:
Arbeitskonzentration: mg/ml;
Methode zur Herstellung der DMSO-Stammlösung: mg Wirkstoff vorgelöst in μL DMSO ( Konzentration der Stammlösung mg/mL, Bitte kontaktieren Sie uns zuerst, wenn die Konzentration die DMSO-Löslichkeit der Wirkstoffcharge überschreitet. )
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügenμL PEG300, mischen und klären, dann hinzufügenμL Tween 80, mischen und klären, dann hinzufügen μL ddH2O, mischen und klären.
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügen μL Maisöl, mischen und klären.
Hinweis: 1. Bitte stellen Sie sicher, dass die Flüssigkeit klar ist, bevor Sie das nächste Lösungsmittel hinzufügen.
2. Achten Sie darauf, das/die Lösungsmittel der Reihe nach hinzuzufügen. Sie müssen sicherstellen, dass die bei der vorherigen Zugabe erhaltene Lösung eine klare Lösung ist, bevor Sie mit der Zugabe des nächsten Lösungsmittels fortfahren. Physikalische Methoden wie Vortex, Ultraschall oder ein heißes Wasserbad können zur Unterstützung des Lösens verwendet werden.
Wirkmechanismus
| Targets/IC50/Ki |
GSK-3
68 nM
|
|---|---|
| In vitro |
AZD2858 ist ein selektiver GSK-3-Inhibitor mit einer IC50 von 68 nM, der die Tau-Phosphorylierung an der S396-Stelle hemmt und den Wnt-Signalweg aktiviert. Die Behandlung mit dieser Verbindung (1 μM, 12 h) auf primär isolierten humanen osteoblastenähnlichen Zellen führt zu einem 3-fachen Anstieg der β-Catenin-Spiegel. Es bewirkt eine β-Catenin-Stabilisierung in humanen und Ratten-Mesenchymalstammzellen, stimuliert die hADSC-Bindung an Osteoblasten und die osteogene Mineralisierung in vitro.
|
| Kinase-Assay |
Tau-Phosphorylierungsassay
|
|
NIH-3T3-Zellen, die 4-repeat Tau exprimieren, werden verwendet, um die funktionelle Aktivität von AZD2858 in vitro zu bewerten. Die Zellen werden in DMEM-Medium mit 2 mM L-Glut und 10 % HiFCS gezüchtet und in einer Konzentration von 6×105 Zellen/Well in 6-Well-Platten ausgesät. In jedem Experiment wird diese Verbindung in Dreifachbestimmung in einer Konzentration von 1, 10, 100, 500, 1000, 2000 und 10.000 nM dosiert. Die Zellen werden 4 h vor der Zelllyse mit 100 μL eiskaltem Lysepuffer (0,5 % NP-40, 10 mM Tris, pH 7,2, 150 mM NaCl, 2 mM EDTA) behandelt. Eine Suspension wird unter Zugabe von Protease- und Phosphataseinhibitoren hergestellt: 50 mM NaF, 0,2 mM NaVO4 und Cocktail-Proteaseinhibitoren. Die Lösung wird dann bei – 80 °C für mindestens 1 h schockgefroren, bevor sie auf Eis aufgetaut und das Lysat durch Zentrifugation geklärt wird, gefolgt von Western Blot nach Standardprotokollen. Nach dem Blockieren werden die Blots über Nacht dem primären Antikörper Phospho-Ser396-tau (1:1000) ausgesetzt, gewaschen und mit dem sekundären Antikörper (Esel-Anti-Kaninchen, 1:5000) inkubiert, gefolgt von einer abschließenden Wäsche. Für die Re-Probierung werden der primäre Antikörper Tau5 (1:200) und der sekundäre Meerrettichperoxidase-gekoppelte Antikörper (Schaf-Anti-Maus, 1:10000) verwendet. Alle Blots werden unter Verwendung von ECL Western Blot-Nachweisreagenzien, Kodak-Röntgenfilmen entwickelt, mittels densitometrischer Analyse quantifiziert, und das Verhältnis von S396-Tau zu Gesamt-Tau (Tau5) wird berechnet.
|
|
| In vivo |
Bei Ratten führt die orale AZD2858-Behandlung nach einer zweiwöchigen Behandlung zu einem dosisabhängigen Anstieg der trabekulären Knochenmasse im Vergleich zur Kontrolle, mit einem maximalen Effekt bei einer Dosis von 20 mg/kg einmal täglich (Gesamt-BMC: 172 % der Kontrolle). Ein kleiner, aber signifikanter Effekt wird auch an kortikalen Stellen beobachtet (Gesamt-BMC: 111 % der Kontrolle). Diese Verbindung (30 μmol/kg) führte bei Ratten täglich über bis zu 3 Wochen zu einem Anstieg sowohl der Mineraldichte (von 28 % nach 2 Wochen und 38 % nach 3 Wochen) als auch des Mineralgehalts (von 81 % nach 2 Wochen und 93 % nach 3 Wochen) in den Kallus. Diese Behandlung lässt die Frakturen schneller heilen, mit einem knöchernen Kallus ohne offensichtliche enchondrale Komponente. Es erzeugt zeitabhängige Veränderungen der Serum-Knochenumsatz-Biomarker und erhöht die Knochenmasse über 28 Tage Exposition bei Ratten. Nach 7 Tagen erhöht diese Verbindung den Knochenbildungs-Biomarker P1NP und reduziert den Resorptions-Biomarker TRAcP-5b, was auf einen erhöhten Knochenanabolismus und eine reduzierte Resorption bei Ratten hinweist.
|
Literatur |
|
Technischer Support
Tel: +1-832-582-8158 Ext:3
Wenn Sie weitere Fragen haben, hinterlassen Sie bitte eine Nachricht.
