nur für Forschungszwecke
SB415286 GSK-3 Inhibitor
Kat.-Nr.S2729
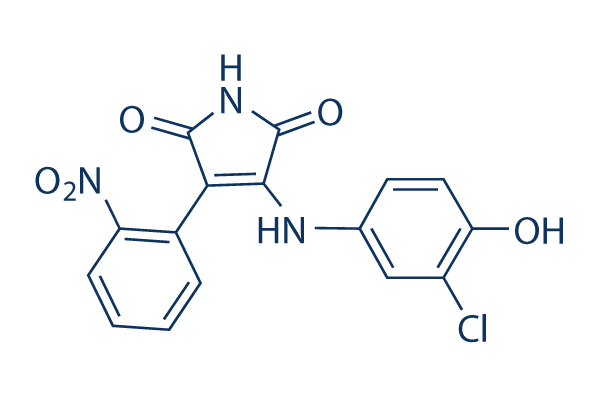
Chemische Struktur
Molekulargewicht: 359.72
Qualitätskontrolle
- In Nature Medicine für seine erstklassige Qualität zitiert
- COA
- NMR
- SDS
- Datenblatt
| Verwandte Ziele | PI3K Akt mTOR ATM/ATR DNA-PK AMPK PDPK1 PTEN PP2A PDK |
|---|---|
| Weitere GSK-3 Inhibitoren | CHIR-99021 (Laduviglusib) Laduviglusib (CHIR-99021) Hydrochloride SB216763 CHIR-98014 TWS119 GSK-3 Inhibitor IX (BIO) LY2090314 Tideglusib AR-A014418 IM-12 |
Zellkultur, Behandlung & Arbeitskonzentration
| Zelllinien | Assay-Typ | Konzentration | Inkubationszeit | Formulierung | Aktivitätsbeschreibung | PMID |
|---|---|---|---|---|---|---|
| CHO cells | Function assay | Stimulation of glycogen synthase in CHO cells expressing human insulin receptor, EC50=45.6 μM | ||||
| Klicken Sie hier, um weitere experimentelle Daten zu Zelllinien anzuzeigen | ||||||
Chemische Informationen, Lagerung & Stabilität
| Molekulargewicht | 359.72 | Formel | C16H10ClN3O5 |
Lagerung (Ab dem Eingangsdatum) | |
|---|---|---|---|---|---|
| CAS-Nr. | 264218-23-7 | SDF herunterladen | Lagerung von Stammlösungen |
|
|
| Synonyme | N/A | Smiles | C1=CC=C(C(=C1)C2=C(C(=O)NC2=O)NC3=CC(=C(C=C3)O)Cl)[N+](=O)[O-] | ||
Löslichkeit
|
In vitro |
DMSO
: 72 mg/mL
(200.15 mM)
Ethanol : 72 mg/mL Water : Insoluble |
Molaritätsrechner
|
In vivo |
|||||
In-vivo-Formulierungsrechner (Klare Lösung)
Schritt 1: Geben Sie die untenstehenden Informationen ein (Empfohlen: Ein zusätzliches Tier zur Berücksichtigung von Verlusten während des Experiments)
Schritt 2: Geben Sie die In-vivo-Formulierung ein (Dies ist nur der Rechner, keine Formulierung. Bitte kontaktieren Sie uns zuerst, wenn es im Abschnitt "Löslichkeit" keine In-vivo-Formulierung gibt.)
Berechnungsergebnisse:
Arbeitskonzentration: mg/ml;
Methode zur Herstellung der DMSO-Stammlösung: mg Wirkstoff vorgelöst in μL DMSO ( Konzentration der Stammlösung mg/mL, Bitte kontaktieren Sie uns zuerst, wenn die Konzentration die DMSO-Löslichkeit der Wirkstoffcharge überschreitet. )
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügenμL PEG300, mischen und klären, dann hinzufügenμL Tween 80, mischen und klären, dann hinzufügen μL ddH2O, mischen und klären.
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügen μL Maisöl, mischen und klären.
Hinweis: 1. Bitte stellen Sie sicher, dass die Flüssigkeit klar ist, bevor Sie das nächste Lösungsmittel hinzufügen.
2. Achten Sie darauf, das/die Lösungsmittel der Reihe nach hinzuzufügen. Sie müssen sicherstellen, dass die bei der vorherigen Zugabe erhaltene Lösung eine klare Lösung ist, bevor Sie mit der Zugabe des nächsten Lösungsmittels fortfahren. Physikalische Methoden wie Vortex, Ultraschall oder ein heißes Wasserbad können zur Unterstützung des Lösens verwendet werden.
Wirkmechanismus
| Targets/IC50/Ki |
GSK-3α
(Cell-free assay) 78 nM
GSK-3β
(Cell-free assay) ~78 nM
|
|---|---|
| In vitro |
SB415286 hemmt GSK3α ATP-kompetitiv mit einem Ki von 31 nM und zeigt eine ähnliche Potenz gegen GSK3β. Diese Verbindung hat wenig oder keine Aktivität gegen 24 andere Proteinkinasen mit IC50 > 10 μM. Sie stimuliert die Glykogensynthese in der Chang-Humanleberzelllinie mit einer EC50 von 2,9 μM und induziert die Expression eines β-Catenin-LEF/TCF-regulierten Reportergens in HEK293-Zellen. Es schützt Neuronen des zentralen und peripheren Nervensystems in Kultur vor dem Tod, der durch eine reduzierte PI3K/Akt/mTOR-Weg-Aktivität induziert wird, und zwar konzentrationsabhängig, was mit der Hemmung der GSK-3-Aktivität und der Modulation der GSK-3-Substrate tau und β-Catenin korreliert ist. In L6-Myotuben induziert diese Chemikalie eine wesentlich stärkere Aktivierung von GS (6,8-fach) im Vergleich zu der durch Insulin (4,2-fach) oder Li (4-fach) hervorgerufenen. Diese Verbindung (10 μM) hemmt die Rapamycin-induzierte Herunterregulierung von Cyclin D1 und blockiert Rapamycin- und -induzierte Apoptosis, was auf eine kritische Rolle von GSK3β bei der Rapamycin-vermittelten -Sensibilisierung hindeutet. Es verhindert Coxsackievirus-induzierten Zelltod dosisabhängig durch Stabilisierung von β-Catenin. Diese Chemikalie übt eine schützende Wirkung auf Wasserstoffperoxid-induzierten Zelltod in B65-Rattenneuroblastomzellen und Neuronen aus, während Lithium die toxischen Wirkungen von Wasserstoffperoxid nicht abschwächt. Ihre Behandlung verstärkt TRAIL- und CH-11-induzierte Apoptosis in HepG2-Zellen. Die Hemmung von GSK-3 durch diese Verbindung verursacht ein Wachstumstopp und Apoptosis von Multiples Myelom (MM)-Zellen durch die Aktivierung des intrinsischen Weges. Es verringert die Lebensfähigkeit von Neuro-2A-Zellen und induziert die Akkumulation von Zellen in der G2/M-Phase des Zellzyklus und anschließende Apoptosis. |
| Kinase-Assay |
GSK-3 Aktivitätsassay
|
|
Die GSK-3-Kinaseaktivität wird in Gegenwart verschiedener Konzentrationen von SB415286 in einer Reaktionsmischung gemessen, die folgende Endkonzentrationen enthält: 1 nM humanes GSK3α oder Kaninchen-GSK3α; 50 mM MOPS pH 7,0; 0,2 mM EDTA; 10 mM Mg-Acetat; 7,5 mM L-Mercaptoethanol; 5 % (w/v) Glycerin; 0,01 % (w/v) Tween-20; 10 % (v/v) DMSO; 28 μM GS-2-Peptidsubstrat. Die GS-2-Peptidsequenz entspricht einer Region der Glykogensynthase, die von GSK-3 phosphoryliert wird. Der Assay wird durch die Zugabe von 0,34 μCi [33P]γ-ATP (IC50-Bestimmungen) oder 2,7 μCi [33P]γ-ATP (Ki-Bestimmungen) initiiert. Die Gesamt-ATP-Konzentration beträgt 10 μM (IC50-Bestimmungen) oder lag zwischen 0 und 45 μM (Ki-Bestimmungen). Nach 30 Minuten Inkubation bei Raumtemperatur wird der Assay durch Zugabe eines Drittels des Assayvolumens von 2,5 % (v/v) H3PO4, das 21 mM ATP enthält, gestoppt. Proben werden auf P30-Phosphocellulosematten aufgetragen, und diese werden sechsmal in 0,5 % (v/v) H3PO4 gewaschen. Die Filtermatten werden in Probenbeutel mit Wallac Betaplate Szintillationsflüssigkeit versiegelt. Der Einbau von 33P in das Substratpeptid wird durch Zählen der Matten in einem Wallac Microbeta Szintillationszähler bestimmt.
|
|
| In vivo |
Die Verabreichung von SB415286 (~10 mg/kg zweimal täglich) reduziert das Ausmaß und den Grad der durch Trinitrobenzolsulfonsäure (TNBS) hervorgerufenen Dickdarmentzündung bei Ratten und verringert den Gewichtsverlust, was mit einer Herunterregulierung der NF-κB-Aktivität zusammenhängt, die an der Erzeugung proinflammatorischer Mediatoren beteiligt ist. Die Behandlung mit dieser Verbindung bei 1 mg/kg verzögert signifikant das Wachstum von Neuro-2A-Zellen in vivo in Nacktmäusen. |
Literatur |
|
Anwendungen
| Methoden | Biomarker | Bilder | PMID |
|---|---|---|---|
| Western blot | β-catenin / XIAP / Bcl-2 GSK-3β / p53 |
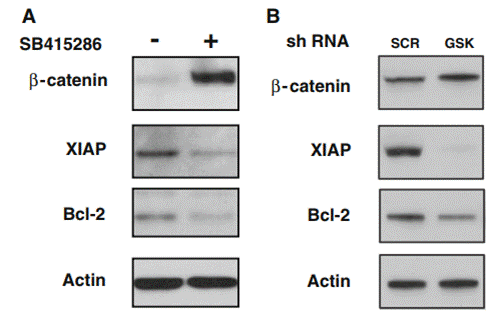
|
21161565 |
Technischer Support
Tel: +1-832-582-8158 Ext:3
Wenn Sie weitere Fragen haben, hinterlassen Sie bitte eine Nachricht.
