nur für Forschungszwecke
Benzocaine Sodium Channel Inhibitor
Kat.-Nr.S4210
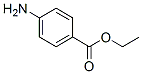
Chemische Struktur
Molekulargewicht: 165.19
Qualitätskontrolle
- In Nature Medicine für seine erstklassige Qualität zitiert
- COA
- NMR
- HPLC
- SDS
- Datenblatt
| Verwandte Ziele | CFTR CRM1 CD markers AChR Calcium Channel Potassium Channel GABA Receptor TRP Channel ATPase GluR |
|---|---|
| Weitere Sodium Channel Inhibitoren | Camostat Mesilate A-803467 cariporide Tolperisone HCl Vinpocetine Veratramine Bulleyaconi cine A Ambroxol HCl Nefopam HCl Benzocaine hydrochloride |
Chemische Informationen, Lagerung & Stabilität
| Molekulargewicht | 165.19 | Formel | C9H11NO2 |
Lagerung (Ab dem Eingangsdatum) | |
|---|---|---|---|---|---|
| CAS-Nr. | 94-09-7 | SDF herunterladen | Lagerung von Stammlösungen |
|
|
| Synonyme | ethyl 4-aminobenzoate | Smiles | CCOC(=O)C1=CC=C(C=C1)N | ||
Löslichkeit
|
In vitro |
DMSO
: 33 mg/mL
(199.76 mM)
Ethanol : 33 mg/mL Water : Insoluble |
Molaritätsrechner
|
In vivo |
|||||
In-vivo-Formulierungsrechner (Klare Lösung)
Schritt 1: Geben Sie die untenstehenden Informationen ein (Empfohlen: Ein zusätzliches Tier zur Berücksichtigung von Verlusten während des Experiments)
Schritt 2: Geben Sie die In-vivo-Formulierung ein (Dies ist nur der Rechner, keine Formulierung. Bitte kontaktieren Sie uns zuerst, wenn es im Abschnitt "Löslichkeit" keine In-vivo-Formulierung gibt.)
Berechnungsergebnisse:
Arbeitskonzentration: mg/ml;
Methode zur Herstellung der DMSO-Stammlösung: mg Wirkstoff vorgelöst in μL DMSO ( Konzentration der Stammlösung mg/mL, Bitte kontaktieren Sie uns zuerst, wenn die Konzentration die DMSO-Löslichkeit der Wirkstoffcharge überschreitet. )
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügenμL PEG300, mischen und klären, dann hinzufügenμL Tween 80, mischen und klären, dann hinzufügen μL ddH2O, mischen und klären.
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügen μL Maisöl, mischen und klären.
Hinweis: 1. Bitte stellen Sie sicher, dass die Flüssigkeit klar ist, bevor Sie das nächste Lösungsmittel hinzufügen.
2. Achten Sie darauf, das/die Lösungsmittel der Reihe nach hinzuzufügen. Sie müssen sicherstellen, dass die bei der vorherigen Zugabe erhaltene Lösung eine klare Lösung ist, bevor Sie mit der Zugabe des nächsten Lösungsmittels fortfahren. Physikalische Methoden wie Vortex, Ultraschall oder ein heißes Wasserbad können zur Unterstützung des Lösens verwendet werden.
Wirkmechanismus
| Targets/IC50/Ki |
Sodium channel
|
|---|---|
| In vitro |
Benzocaine blockiert µ1 Wildtyp Na+-Ströme dosisabhängig mit einer IC50 von 0,8 mM in HEK293T-Zellen. Diese Verbindung (1 mM) blockiert etwa 55 % des Wildtyp-Na+-Stroms, aber etwa 95 % des µ1-N1584A-Mutantenstroms. Es (1 mM) blockiert etwa 55 % der Wildtyp-µ1-Ströme, aber etwa 80 % des µ1-I1575A-Mutantenstroms. Diese Chemikalie führt zu einem biphasischen (protektiven/induktiven) konzentrationsabhängigen hämolytischen Effekt auf Rattenerythrozyten, mit einem effektiven Benzocaine:Lipid-Molverhältnis in der Membran für Schutz (RePROT), Beginn der Hämolyse (ReSAT) und 100 % Membransolubilisierung (ReSOL) von 1,0:1, 1,1:1 bzw. 1,3:1. Es und 4-Hydroxybenzoat interagieren während wiederholter Impulse mit den offenen und inaktivierten Kanälen, aber während des Interimpulses dissoziiert der Komplex zu schnell, um eine ausreichende gebrauchsabhängige Blockade der Na+-Ströme zu akkumulieren. Diese Verbindung (500 μM) reduziert die Spitzen- und Steady-State-Ströme und erhöht die Amplitude der inaktivierenden Komponente von 21,7 % auf 30,2 % (n=7, P<0.05), so dass die Benzocaine-induzierte Blockade am Ende der Impulse auf +60 mV durchschnittlich 30,9 % betrug (n=7). Es (500 μM) beschleunigt signifikant die Anfangsphase der Deaktivierung (τf=27.2±2.6 ms, n=7, P<0.01), modifiziert aber nicht die langsame Phase des Tail-Stromabfalls. Diese Chemikalie bindet mit hoher Affinität an eine intrazelluläre Bindungsstelle, um ‚Agonisten‘-Effekte zu erzeugen, und an eine Subsite mit geringer Affinität, die sich ebenfalls im inneren Mund befindet, um die blockierenden Effekte zu erzeugen. Es und extrazelluläres K(+) interagieren, um die Spannungsabhängigkeit der Kanalöffnung zu modifizieren. |
| In vivo |
Benzocaine wird sowohl durch lebensfähige als auch durch nicht lebensfähige Haut des haarlosen Meerschweinchens schnell und ähnlich absorbiert; die Absorption der beiden sauren Verbindungen, Benzoesäure und PABA, ist durch nicht lebensfähige Haut größer. |
Literatur |
|
Klinische Studieninformationen
(Daten von https://clinicaltrials.gov, aktualisiert am 2024-05-22)
| NCT-Nummer | Rekrutierung | Erkrankungen | Sponsor/Kooperationspartner | Startdatum | Phasen |
|---|---|---|---|---|---|
| NCT06165432 | Completed | Pain |
B.P. Koirala Institute of Health Sciences |
March 19 2021 | Phase 4 |
| NCT03116737 | Completed | Pain|Acute Otitis Media |
Lachlan Pharma Holdings |
January 3 2017 | Phase 3 |
| NCT02092454 | Completed | Pain|Acute Otitis Media |
Otic Therapy LLC |
September 2013 | Phase 2 |
Technischer Support
Tel: +1-832-582-8158 Ext:3
Wenn Sie weitere Fragen haben, hinterlassen Sie bitte eine Nachricht.
