nur für Forschungszwecke
OC000459 GPR Antagonist
Kat.-Nr.S2822
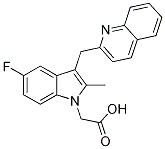
Chemische Struktur
Molekulargewicht: 348.37
Qualitätskontrolle
- In Nature Medicine für seine erstklassige Qualität zitiert
- COA
- NMR
- SDS
- Datenblatt
Chemische Informationen, Lagerung & Stabilität
| Molekulargewicht | 348.37 | Formel | C21H17FN2O2 |
Lagerung (Ab dem Eingangsdatum) | |
|---|---|---|---|---|---|
| CAS-Nr. | 851723-84-7 | SDF herunterladen | Lagerung von Stammlösungen |
|
|
| Synonyme | N/A | Smiles | CC1=C(C2=C(N1CC(=O)O)C=CC(=C2)F)CC3=NC4=CC=CC=C4C=C3 | ||
Löslichkeit
|
In vitro |
DMSO
: 4 mg/mL
(11.48 mM)
Water : Insoluble Ethanol : Insoluble |
Molaritätsrechner
|
In vivo |
|||||
In-vivo-Formulierungsrechner (Klare Lösung)
Schritt 1: Geben Sie die untenstehenden Informationen ein (Empfohlen: Ein zusätzliches Tier zur Berücksichtigung von Verlusten während des Experiments)
Schritt 2: Geben Sie die In-vivo-Formulierung ein (Dies ist nur der Rechner, keine Formulierung. Bitte kontaktieren Sie uns zuerst, wenn es im Abschnitt "Löslichkeit" keine In-vivo-Formulierung gibt.)
Berechnungsergebnisse:
Arbeitskonzentration: mg/ml;
Methode zur Herstellung der DMSO-Stammlösung: mg Wirkstoff vorgelöst in μL DMSO ( Konzentration der Stammlösung mg/mL, Bitte kontaktieren Sie uns zuerst, wenn die Konzentration die DMSO-Löslichkeit der Wirkstoffcharge überschreitet. )
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügenμL PEG300, mischen und klären, dann hinzufügenμL Tween 80, mischen und klären, dann hinzufügen μL ddH2O, mischen und klären.
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügen μL Maisöl, mischen und klären.
Hinweis: 1. Bitte stellen Sie sicher, dass die Flüssigkeit klar ist, bevor Sie das nächste Lösungsmittel hinzufügen.
2. Achten Sie darauf, das/die Lösungsmittel der Reihe nach hinzuzufügen. Sie müssen sicherstellen, dass die bei der vorherigen Zugabe erhaltene Lösung eine klare Lösung ist, bevor Sie mit der Zugabe des nächsten Lösungsmittels fortfahren. Physikalische Methoden wie Vortex, Ultraschall oder ein heißes Wasserbad können zur Unterstützung des Lösens verwendet werden.
Wirkmechanismus
| Targets/IC50/Ki |
DP2
13 nM
|
|---|---|
| In vitro |
OC000459 hemmt die Bindung von [3H]PGD2 an Membranen von CHO-Zellen, die mit humanem DP2 transfiziert sind, mit einem Ki von 13 nM. Diese Verbindung verdrängt auch [3H]PGD2 von Membranen humaner Th2-Lymphozyten mit einem Ki von 4 nM. Es antagonisiert die PGD2-vermittelte Kalziummobilisierung konzentrationsabhängig mit einer IC50 von 28 nM in intakten CHO-Zellen, die DP2 exprimieren. Diese Chemikalie hemmt die Chemotaxis humaner Th2-Zellen als Reaktion auf PGD2 (10 nM) mit einer IC50 von 28 nM. Es antagonisiert die Wirkung von PGD2 kompetitiv sowohl in der isolierten Leukozytenpräparation als auch in heparinisiertem humanem Vollblut. Diese Verbindung hemmt die Eosinophilen-Formveränderung als Reaktion auf DK-PGD2 mit einer IC50 von 11 nM. Es hemmt die Aktivierung von Th2-Zellen und Eosinophilen als Reaktion auf Mastzell-Überstände.
|
| In vivo |
OC000459, in Dosen von 2 mg/kg p.o. an Sprague-Dawley-Ratten verabreicht, zeigt eine Plasmahalbwertszeit von 2,9 Stunden, eine maximale Plasmakonzentration, die nach 1,3 Stunden erreicht wird, und eine maximale Plasmakonzentration von 1,54 μg/mL. Diese Verbindung, 0,5 Stunden vor der Injektion von DK-PGD2 oral verabreicht, führt zu einer dosisabhängigen Reduktion der Bluteosinophilie mit einer ED50 von 0,04 mg/kg bei Ratten. Oral 0,5 Stunden vor der Injektion von DK-PGD2 verabreicht, führt sie auch zu einer dosisabhängigen Hemmung der Eosinophilenakkumulation mit einer ED50 von 0,01 mg/kg bei Ratten. Diese Chemikalie (200 mg zweimal täglich für 28 Tage), bei Patienten mit moderatem persistentem Asthma verabreicht, zeigt eine Verbesserung der Lebensqualität, analysiert sowohl für die Full Analysis (FA)-Population als auch für die Per Protocol (PP)-Population. Bei diesen Patienten verbessert sie die nächtlichen Symptom-Scores, reduziert die geometrische mittlere Eosinophilenzahl im Sputum und die Atemwegsinfektionen. Diese Verbindung (200 mg zweimal täglich) hemmt die späteren asthmatischen Reaktionen und den post-allergenen Anstieg der Sputum-Eosinophilen bei steroidnaiven Asthmatikern.
|
Literatur |
|
Klinische Studieninformationen
(Daten von https://clinicaltrials.gov, aktualisiert am 2024-05-22)
| NCT-Nummer | Rekrutierung | Erkrankungen | Sponsor/Kooperationspartner | Startdatum | Phasen |
|---|---|---|---|---|---|
| NCT02560610 | Completed | Severe Eosinophilic Asthma |
Chiesi Farmaceutici S.p.A.|Atopix Therapeutics Ltd. |
September 2016 | Phase 2 |
| NCT01056783 | Completed | Eosinophilic Esophagitis |
Oxagen Ltd |
August 2010 | Phase 2 |
| NCT01056575 | Completed | Healthy Volunteers |
Oxagen Ltd |
February 2010 | Phase 1 |
| NCT01448902 | Completed | Allergic Rhinitis |
Oxagen Ltd |
March 2007 | Phase 2 |
| NCT00290381 | Completed | Allergic Rhinitis |
Trevor Hansel|Oxagen Ltd|Imperial College London |
Phase 1|Phase 2 |
Technischer Support
Tel: +1-832-582-8158 Ext:3
Wenn Sie weitere Fragen haben, hinterlassen Sie bitte eine Nachricht.
