nur für Forschungszwecke
Sitagliptin DPP Inhibitor
Kat.-Nr.S5079
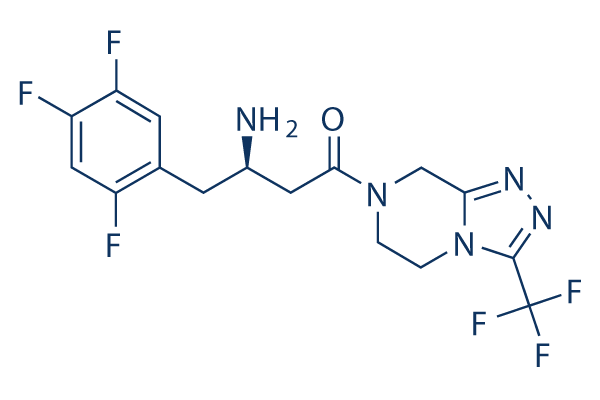
Chemische Struktur
Molekulargewicht: 407.31
Qualitätskontrolle
Chemische Informationen, Lagerung & Stabilität
| Molekulargewicht | 407.31 | Formel | C16H15F6N5O |
Lagerung (Ab dem Eingangsdatum) | |
|---|---|---|---|---|---|
| CAS-Nr. | 486460-32-6 | -- | Lagerung von Stammlösungen |
|
|
| Synonyme | MK-0431 | Smiles | C1CN2C(=NN=C2C(F)(F)F)CN1C(=O)CC(CC3=CC(=C(C=C3F)F)F)N | ||
Löslichkeit
|
In vitro |
DMSO
: 81 mg/mL
(198.86 mM)
Ethanol : 81 mg/mL Water : 5 mg/mL (Ultrasonic and heating for 10 minutes, at 60℃.) |
Molaritätsrechner
|
In vivo |
|||||
In-vivo-Formulierungsrechner (Klare Lösung)
Schritt 1: Geben Sie die untenstehenden Informationen ein (Empfohlen: Ein zusätzliches Tier zur Berücksichtigung von Verlusten während des Experiments)
Schritt 2: Geben Sie die In-vivo-Formulierung ein (Dies ist nur der Rechner, keine Formulierung. Bitte kontaktieren Sie uns zuerst, wenn es im Abschnitt "Löslichkeit" keine In-vivo-Formulierung gibt.)
Berechnungsergebnisse:
Arbeitskonzentration: mg/ml;
Methode zur Herstellung der DMSO-Stammlösung: mg Wirkstoff vorgelöst in μL DMSO ( Konzentration der Stammlösung mg/mL, Bitte kontaktieren Sie uns zuerst, wenn die Konzentration die DMSO-Löslichkeit der Wirkstoffcharge überschreitet. )
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügenμL PEG300, mischen und klären, dann hinzufügenμL Tween 80, mischen und klären, dann hinzufügen μL ddH2O, mischen und klären.
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügen μL Maisöl, mischen und klären.
Hinweis: 1. Bitte stellen Sie sicher, dass die Flüssigkeit klar ist, bevor Sie das nächste Lösungsmittel hinzufügen.
2. Achten Sie darauf, das/die Lösungsmittel der Reihe nach hinzuzufügen. Sie müssen sicherstellen, dass die bei der vorherigen Zugabe erhaltene Lösung eine klare Lösung ist, bevor Sie mit der Zugabe des nächsten Lösungsmittels fortfahren. Physikalische Methoden wie Vortex, Ultraschall oder ein heißes Wasserbad können zur Unterstützung des Lösens verwendet werden.
Wirkmechanismus
| Targets/IC50/Ki |
DPP-4
(Cell-free) 18 nM
|
|---|---|
| In vitro |
Sitagliptin weist eine > 2600-fache Selektivitätsmarge gegenüber DPP8, DPP9 und anderen Mitgliedern der Dipeptidylpeptidase-Familie auf (d. h. Potenz gegen DPP-4 vs. DPP8/9). Diese Verbindung reduziert die In-vitro-Migration isolierter splenischer CD4-T-Zellen über einen Signalweg, der die cAMP/PKA/Rac1-Aktivierung beinhaltet. Es übt eine neuartige, direkte Wirkung aus, um die GLP-1-Sekretion durch die intestinale L-Zelle über einen DPP-4-unabhängigen, Proteinkinase-A- und MEK-ERK1/2-abhängigen Signalweg zu stimulieren. Es reduziert daher die Auswirkung der Autoimmunität auf das Transplantatüberleben.
|
| In vivo |
Sitagliptin wird nach oraler Verabreichung gut resorbiert, mit einer Bioverfügbarkeit von 87 %. Es hat eine scheinbare terminale Halbwertszeit von 10–12 h bei Dosen von 25–100 mg und wird hauptsächlich (≈ 80 %) als unveränderte Verbindung über die Nieren ausgeschieden. Diese Verbindung interferiert nicht mit den P450-Cytochrom-Enzymen, noch wurden signifikante Arzneimittelwechselwirkungen berichtet. Es wurde gezeigt, dass es die DPP-4-Aktivität innerhalb von 1–2 h nach Verabreichung um > 90 % hemmt. Es hat eine kurze Halbwertszeit bei Mäusen (1–2 h). Die chronische Sitagliptin-Behandlung in einem nicht-genetischen Mausmodell für Typ-2-Diabetes führt zu einer signifikanten Verbesserung der glykämischen Kontrolle. Die verbesserte Glukosehomöostase korreliert mit der Wiederherstellung der normalen Inselzellmasse (α- und β-Zellen), -architektur und Insulinsekretionskapazität als Reaktion auf Glukosestimulation. Diese Verbindung verlängert das Überleben von Inseltransplantaten bei Streptozotocin-induzierten und NOD-Mäusen. Die In-vivo-Verabreichung dieser Chemikalie reduziert die Migration von Lymphknoten- und Milz-CD4+-T-Zellen, gemessen in vitro, über inkretin- und nicht-inkretin-vermittelte Effekte bzw. infiltrierten milz-sDPP-IV-responsive CD4+-T-Zellen und Lymphknoten-inkretin-nicht-responsive CD4+-T-Zellen selektiv die Inseln diabetischer NOD-Mäuse nach Injektion in die Schwanzvene. Es unterdrückte signifikant die Epileptogenese bei PTZ (Pentylentetrazol)-induzierten Anfällen. Diese Verbindung wirkte neuronalen Schäden und allen biochemischen und histochemischen Veränderungen entgegen, die durch PTZ induziert wurden. Orales Sitagliptin kann die Hippocampus-Neurogenese fördern, den Hippocampus-oxidativen Stress entgegenwirken und den Rückgang der Kognition bei Mäusen verhindern.
|
Literatur |
|
Klinische Studieninformationen
(Daten von https://clinicaltrials.gov, aktualisiert am 2024-05-22)
| NCT-Nummer | Rekrutierung | Erkrankungen | Sponsor/Kooperationspartner | Startdatum | Phasen |
|---|---|---|---|---|---|
| NCT05219409 | Not yet recruiting | Type 1 Diabetes |
University of Milan |
July 2023 | Phase 2|Phase 3 |
| NCT05403281 | Completed | Healthy Subjects |
Dong Wha Pharmaceutical Co. Ltd. |
November 5 2021 | Phase 1 |
| NCT03790839 | Completed | Patients |
Hua Medicine Limited |
January 31 2019 | Phase 1 |
| NCT03359590 | Completed | Pharmacological Action |
Profil Institut für Stoffwechselforschung GmbH|Merck Sharp & Dohme LLC |
March 21 2018 | Phase 2 |
Technischer Support
Tel: +1-832-582-8158 Ext:3
Wenn Sie weitere Fragen haben, hinterlassen Sie bitte eine Nachricht.
