nur für Forschungszwecke
3BDO mTOR Aktivator
Kat.-Nr.S8317
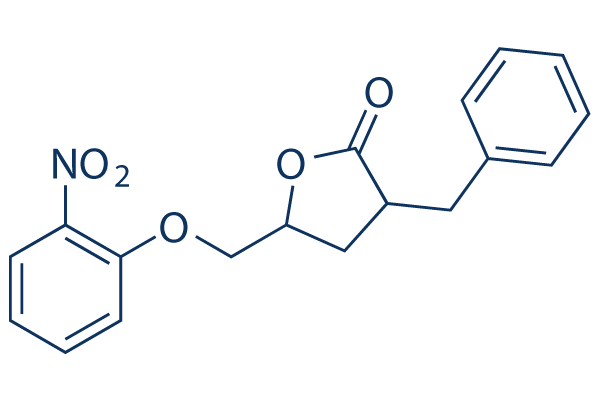
Chemische Struktur
Molekulargewicht: 327.33
Qualitätskontrolle
| Verwandte Ziele | PI3K Akt GSK-3 ATM/ATR DNA-PK AMPK PDPK1 PTEN PP2A PDK |
|---|---|
| Weitere mTOR Inhibitoren | Torin 1 Torin 2 AZD8055 Ridaforolimus (Deforolimus, MK-8669) Sapanisertib (MLN0128, INK-128) Torkinib (PP242) MHY1485 Vistusertib (AZD2014) KU-0063794 OSI-027 |
Chemische Informationen, Lagerung & Stabilität
| Molekulargewicht | 327.33 | Formel | C18H17NO5 |
Lagerung (Ab dem Eingangsdatum) | |
|---|---|---|---|---|---|
| CAS-Nr. | 890405-51-3 | SDF herunterladen | Lagerung von Stammlösungen |
|
|
| Synonyme | 3-benzyl-5-((2-nitrophenoxy) methyl)-dihydrofuran-2(3H)-one | Smiles | C1C(C(=O)OC1COC2=CC=CC=C2[N+](=O)[O-])CC3=CC=CC=C3 | ||
Löslichkeit
|
In vitro |
DMSO
: 65 mg/mL
(198.57 mM)
Ethanol : 19.7 mg/mL Water : Insoluble |
Molaritätsrechner
|
In vivo |
|||||
In-vivo-Formulierungsrechner (Klare Lösung)
Schritt 1: Geben Sie die untenstehenden Informationen ein (Empfohlen: Ein zusätzliches Tier zur Berücksichtigung von Verlusten während des Experiments)
Schritt 2: Geben Sie die In-vivo-Formulierung ein (Dies ist nur der Rechner, keine Formulierung. Bitte kontaktieren Sie uns zuerst, wenn es im Abschnitt "Löslichkeit" keine In-vivo-Formulierung gibt.)
Berechnungsergebnisse:
Arbeitskonzentration: mg/ml;
Methode zur Herstellung der DMSO-Stammlösung: mg Wirkstoff vorgelöst in μL DMSO ( Konzentration der Stammlösung mg/mL, Bitte kontaktieren Sie uns zuerst, wenn die Konzentration die DMSO-Löslichkeit der Wirkstoffcharge überschreitet. )
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügenμL PEG300, mischen und klären, dann hinzufügenμL Tween 80, mischen und klären, dann hinzufügen μL ddH2O, mischen und klären.
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügen μL Maisöl, mischen und klären.
Hinweis: 1. Bitte stellen Sie sicher, dass die Flüssigkeit klar ist, bevor Sie das nächste Lösungsmittel hinzufügen.
2. Achten Sie darauf, das/die Lösungsmittel der Reihe nach hinzuzufügen. Sie müssen sicherstellen, dass die bei der vorherigen Zugabe erhaltene Lösung eine klare Lösung ist, bevor Sie mit der Zugabe des nächsten Lösungsmittels fortfahren. Physikalische Methoden wie Vortex, Ultraschall oder ein heißes Wasserbad können zur Unterstützung des Lösens verwendet werden.
Wirkmechanismus
| Targets/IC50/Ki |
FKBP1A
(Cell-free assay) |
|---|---|
| In vitro |
3BDO hemmt die Autophagie in humanen Nabelschnurvenenendothelzellen (HUVECs) und neuronalen Zellen. Es unterdrückt die Lipopolysaccharid-induzierte autophagische Verletzung von HUVECs durch Herunterregulierung der Proteinspiegel von NUPR1 (Kernprotein, Transkriptionsregulator) und TP53 (Tumorprotein p53), der nuklearen Translokation von TP53 und der Überproduktion reaktiver Sauerstoffspezies. Diese Verbindung aktiviert mTOR durch die Bindung an FKBP1A (FK506-Bindungsprotein 1A, 12 kDa). Es verringert stark den Spiegel einer langen nicht-kodierenden RNA (lncRNA), die aus der 3'-untranslatierten Region (3'UTR) von TGFB2 stammt und als FLJ11812 bekannt ist, beeinflusst jedoch nicht die TGFB2-Expression. Der ATG13-Proteinspiegel ist zusammen mit dem durch diese Verbindung verringerten FLJ11812-Spiegel reduziert. Es hemmt die exzessive Aβ (25 bis 35)-Peptid-induzierte Autophagie in PC12-Neuronalzellen und erhöhte die Phosphorylierung von RPS6KB1. Diese Chemikalie könnte die Apoptose und Seneszenz menschlicher Nabelschnurvenen-EC (HUVEC) hemmen, die durch Entzug von Serum und basischem Fibroblasten-Wachstumsfaktor 2 induziert werden. Sie schützte selektiv vaskuläre ECs (VECs) und hemmte die Proliferation und Migration vaskulärer glatter Muskelzellen (VSMC). Es (20-60 μg/ml) könnte die VEC-Apoptose hemmen und die Integrin-β4-Expression unterdrücken, konnte aber den ROS-Spiegel, der durch Entzug von Serum und FGF-2 induziert wurde, nicht senken.
|
| In vivo |
In-vivo-Experimente zeigten, dass 3BDO ein gutes Sicherheitsprofil aufweist. Die Behandlung mit dieser Verbindung konnte die Anzahl der Autophagosomen signifikant reduzieren und die neuronale Funktion bei transgenen App- und Psen1-Mäusen verbessern. Es aktivierte mTOR in vivo und verringerte den Proteingehalt von ATG13 im Plaque-Endothel von apoE-/- Mäusen. Es beeinflusste die Aktivität von mTOR und Autophagie in der Makrophagen-Zelllinie RAW246.7 und den vaskulären glatten Muskelzellen von apoE-/- Mäusen nicht, unterdrückte jedoch den Zelltod der Plaque-Endothelzellen und schränkte die Entwicklung der Atherosklerose bei den Mäusen ein. Diese Chemikalie schützte VECs durch Aktivierung von mTOR und stabilisierte somit atherosklerotische Läsionen bei apoE-/- Mäusen.
|
Literatur |
|
Technischer Support
Tel: +1-832-582-8158 Ext:3
Wenn Sie weitere Fragen haben, hinterlassen Sie bitte eine Nachricht.
