nur für Forschungszwecke
Raloxifene HCl Estrogen/progestogen Receptor Modulator
Kat.-Nr.S1227
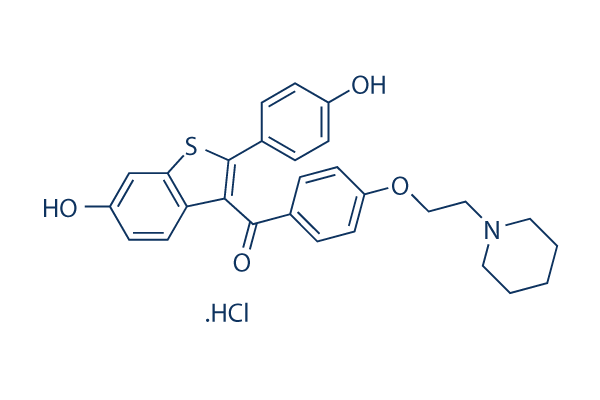
Chemische Struktur
Molekulargewicht: 510.04
Qualitätskontrolle
| Verwandte Ziele | Adrenergic Receptor GPR Androgen Receptor Glucocorticoid Receptor ACE RAAS Progesterone Receptor Opioid Receptor PGES THR |
|---|---|
| Weitere Estrogen/progestogen Receptor Inhibitoren | Elacestrant (RAD1901) Dihydrochloride Vepdegestrant (ARV-471) MPP dihydrochloride Kaempferol Cholesterol G15 Endoxifen HCl Licochalcone A Chrysin Pregnenolone |
Chemische Informationen, Lagerung & Stabilität
| Molekulargewicht | 510.04 | Formel | C28H27NO4S.HCl |
Lagerung (Ab dem Eingangsdatum) | |
|---|---|---|---|---|---|
| CAS-Nr. | 82640-04-8 | SDF herunterladen | Lagerung von Stammlösungen |
|
|
| Synonyme | LY156758 (Keoxifene) HCl | Smiles | C1CCN(CC1)CCOC2=CC=C(C=C2)C(=O)C3=C(SC4=C3C=CC(=C4)O)C5=CC=C(C=C5)O.Cl | ||
Löslichkeit
|
In vitro |
DMSO
: 100 mg/mL
(196.06 mM)
Water : Insoluble Ethanol : Insoluble |
Molaritätsrechner
|
In vivo |
|||||
In-vivo-Formulierungsrechner (Klare Lösung)
Schritt 1: Geben Sie die untenstehenden Informationen ein (Empfohlen: Ein zusätzliches Tier zur Berücksichtigung von Verlusten während des Experiments)
Schritt 2: Geben Sie die In-vivo-Formulierung ein (Dies ist nur der Rechner, keine Formulierung. Bitte kontaktieren Sie uns zuerst, wenn es im Abschnitt "Löslichkeit" keine In-vivo-Formulierung gibt.)
Berechnungsergebnisse:
Arbeitskonzentration: mg/ml;
Methode zur Herstellung der DMSO-Stammlösung: mg Wirkstoff vorgelöst in μL DMSO ( Konzentration der Stammlösung mg/mL, Bitte kontaktieren Sie uns zuerst, wenn die Konzentration die DMSO-Löslichkeit der Wirkstoffcharge überschreitet. )
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügenμL PEG300, mischen und klären, dann hinzufügenμL Tween 80, mischen und klären, dann hinzufügen μL ddH2O, mischen und klären.
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügen μL Maisöl, mischen und klären.
Hinweis: 1. Bitte stellen Sie sicher, dass die Flüssigkeit klar ist, bevor Sie das nächste Lösungsmittel hinzufügen.
2. Achten Sie darauf, das/die Lösungsmittel der Reihe nach hinzuzufügen. Sie müssen sicherstellen, dass die bei der vorherigen Zugabe erhaltene Lösung eine klare Lösung ist, bevor Sie mit der Zugabe des nächsten Lösungsmittels fortfahren. Physikalische Methoden wie Vortex, Ultraschall oder ein heißes Wasserbad können zur Unterstützung des Lösens verwendet werden.
Wirkmechanismus
| Merkmale |
Raloxifene is as effective as tamoxifen in reducing the incidence of breast cancer in postmenopausal women at increased risk.
|
|---|---|
| Targets/IC50/Ki |
ER
(Cell-free assay) 5.7 nM
|
| In vitro |
Raloxifen hat sich als potenter unkompetitiver Inhibitor der durch humane Leber-Aldehydoxidase katalysierten Oxidation von Phthalazin, Vanillin und dem Nikotin-Delta1'(5')-Iminium-Ion erwiesen, mit Ki-Werten von 0,87 nM, 1,2 nM und 1,4 nM. Raloxifen wurde auch als nichtkompetitiver Inhibitor einer durch Aldehydoxidase katalysierten Reduktionsreaktion einer Hydroxamsäure-haltigen Verbindung mit einem Ki von 51 nM gezeigt. Raloxifen aktiviert den TGF-beta-3-Promotor als vollständiger Agonist in nanomolaren Konzentrationen, und Raloxifen hemmt die Expression des Estrogen-Response-Element-enthaltenden Vitellogenin-Promotors als reiner Estrogenantagonist in transienten Transfektionsassays. |
| In vivo |
Raloxifene stellt sowohl die Knochenmineraldichte als auch die TGF-beta-3-Messenger-RNA-Expression im Femur auf die Werte intakter Ratten wieder her. Raloxifene (0,1 mg/kg-10 mg/kg, oral für 5 Wochen) erhöht die Knochenmineraldichte im distalen Femur und der proximalen Tibia bei ovariektomierten (OVX) Ratten. Raloxifene reduziert den Serumcholesterolspiegel oral mit einer ED50 von 0,2 mg/kg bei ovariektomierten (OVX) Ratten. Raloxifene unterscheidet sich dramatisch von Estrogen durch das Fehlen signifikanter estrogener Effekte auf das Uterusgewebe. Raloxifene verhindert die spongiöse Osteopenie sowie die Veränderungen des radialen Knochenwachstums, der Knochenresorption und des Blutcholesterins, ist aber weniger wirksam bei der Reduzierung der spongiösen Knochenbildung und verhindert nicht die Uterusatrophie bei ovariektomierten (OVX) Ratten. Raloxifene (3 mg/kg/Tag) hat eine potente estrogene Aktivität auf die Knochenresorption und das Serumcholesterin, eine geringere Wirkung auf die Knochenbildung und minimale Aktivität auf das Uterusfeuchtgewicht bei ovariektomierten (OVX) Ratten. |
Literatur |
|
Anwendungen
| Methoden | Biomarker | Bilder | PMID |
|---|---|---|---|
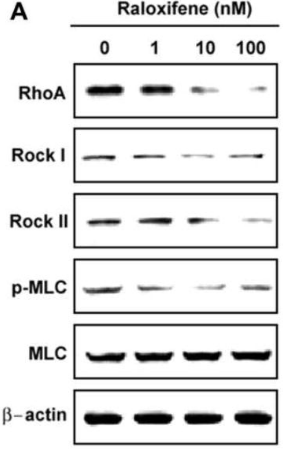
| Western blot | RhoA / Rock I / Rock II / p-MLC / MLC p-STAT3 / STAT3 / Survivin / Bcl-2 / Bcl-xl |
|
20970835 |
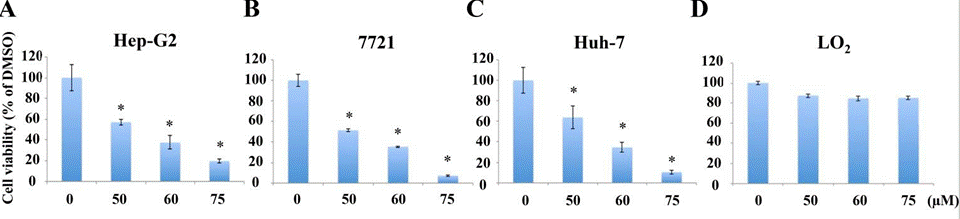
| Growth inhibition assay | Cell viability |
|
28430601 |
Klinische Studieninformationen
(Daten von https://clinicaltrials.gov, aktualisiert am 2024-05-22)
| NCT-Nummer | Rekrutierung | Erkrankungen | Sponsor/Kooperationspartner | Startdatum | Phasen |
|---|---|---|---|---|---|
| NCT01973738 | Unknown status | Selective Estrogen Receptor Modulator |
Toshihiko Kono|Tomidahama Hospital |
January 2012 | -- |
| NCT02977949 | Unknown status | Selective Estrogen Receptor Modulator (SERM) |
Toshihiko Kono|Tomidahama Hospital |
January 2012 | -- |
| NCT01573637 | Completed | Schizophrenia in Post Menopausal Women |
Fundació Sant Joan de Déu|Hospital Sant Joan de Deu|Parc Sanitari Sant Joan de Déu|Stanley Medical Research Institute |
July 2011 | Phase 3 |
Technischer Support
Tel: +1-832-582-8158 Ext:3
Wenn Sie weitere Fragen haben, hinterlassen Sie bitte eine Nachricht.
