nur für Forschungszwecke
Palomid 529 (P529) mTOR Inhibitor
Kat.-Nr.S2238
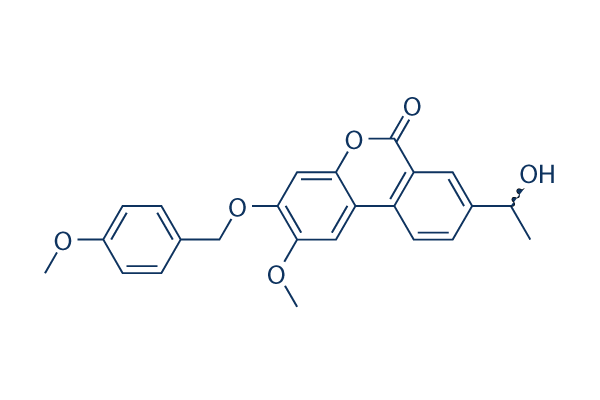
Chemische Struktur
Molekulargewicht: 406.43
Qualitätskontrolle
| Verwandte Ziele | PI3K Akt GSK-3 ATM/ATR DNA-PK AMPK PDPK1 PTEN PP2A PDK |
|---|---|
| Weitere mTOR Inhibitoren | Torin 1 Torin 2 AZD8055 Ridaforolimus (Deforolimus, MK-8669) Sapanisertib (MLN0128, INK-128) Torkinib (PP242) MHY1485 Vistusertib (AZD2014) KU-0063794 OSI-027 |
Chemische Informationen, Lagerung & Stabilität
| Molekulargewicht | 406.43 | Formel | C24H22O6 |
Lagerung (Ab dem Eingangsdatum) | |
|---|---|---|---|---|---|
| CAS-Nr. | 914913-88-5 | SDF herunterladen | Lagerung von Stammlösungen |
|
|
| Synonyme | SG 00529 | Smiles | CC(C1=CC2=C(C=C1)C3=CC(=C(C=C3OC2=O)OCC4=CC=C(C=C4)OC)OC)O | ||
Löslichkeit
|
In vitro |
DMSO
: 81 mg/mL
(199.29 mM)
Water : Insoluble Ethanol : Insoluble |
Molaritätsrechner
|
In vivo |
|||||
In-vivo-Formulierungsrechner (Klare Lösung)
Schritt 1: Geben Sie die untenstehenden Informationen ein (Empfohlen: Ein zusätzliches Tier zur Berücksichtigung von Verlusten während des Experiments)
Schritt 2: Geben Sie die In-vivo-Formulierung ein (Dies ist nur der Rechner, keine Formulierung. Bitte kontaktieren Sie uns zuerst, wenn es im Abschnitt "Löslichkeit" keine In-vivo-Formulierung gibt.)
Berechnungsergebnisse:
Arbeitskonzentration: mg/ml;
Methode zur Herstellung der DMSO-Stammlösung: mg Wirkstoff vorgelöst in μL DMSO ( Konzentration der Stammlösung mg/mL, Bitte kontaktieren Sie uns zuerst, wenn die Konzentration die DMSO-Löslichkeit der Wirkstoffcharge überschreitet. )
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügenμL PEG300, mischen und klären, dann hinzufügenμL Tween 80, mischen und klären, dann hinzufügen μL ddH2O, mischen und klären.
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügen μL Maisöl, mischen und klären.
Hinweis: 1. Bitte stellen Sie sicher, dass die Flüssigkeit klar ist, bevor Sie das nächste Lösungsmittel hinzufügen.
2. Achten Sie darauf, das/die Lösungsmittel der Reihe nach hinzuzufügen. Sie müssen sicherstellen, dass die bei der vorherigen Zugabe erhaltene Lösung eine klare Lösung ist, bevor Sie mit der Zugabe des nächsten Lösungsmittels fortfahren. Physikalische Methoden wie Vortex, Ultraschall oder ein heißes Wasserbad können zur Unterstützung des Lösens verwendet werden.
Wirkmechanismus
| Targets/IC50/Ki |
mTORC1
mTORC2
|
|---|---|
| In vitro |
Palomid 529 (P529) hemmt die Proliferation und erhöht die Apoptose von Endothelzellen, wobei sowohl die VEGF-getriebene als auch die bFGF-getriebene Endothelzellproliferation mit einer IC50 von 20 nM bzw. 30 nM gehemmt wird. Es behält die Fähigkeit bei, die Apoptose von Endothelzellen zu induzieren und die VEGF-A-getriebene Phosphorylierung von pAktS473, pGSK3βS9 und pS6 zu verringern. Dieses Compound verhindert jedoch weder die phosphorylierte Mitogen-aktivierte Proteinkinase (pMAPK) noch pAktT308 so potent wie pAktS473. Es reduziert nicht nur die proliferative Reaktion in der ischämischen Netzhaut, sondern verbessert auch die Organisation und Struktur der sich bildenden Gefäße. P529 zeigt eine potente antiproliferative Aktivität im NCI-60-Zelllinien-Panel, mit einer wachstumshemmenden 50 (GI50) <35 μM. Darüber hinaus verstärkt es signifikant die antiproliferative Wirkung der Strahlung in Prostatakrebszellen (PC-3), was zu einer konzentrationsabhängigen Wachstumshemmung der PC-3-Zellen führt. Dosen von 2 und 7 μM führten zu einer Wachstumshemmung von 30 bzw. 60 %. Es hemmt die strahleninduzierte p-Akt-Aktivierung und verringert das Bcl-2/Bax-Verhältnis in PC-3. Dieses Compound hemmt nicht nur die strahleninduzierte Überexpression von Id-1 und VEGF, sondern reguliert auch die strahleninduzierte MMP-2 und MMP-9 herunter. |
| Kinase-Assay |
Östrogenrezeptor-Bindungsassays
|
|
Die Proteine werden mit Kaninchen-Retikulozytenlysaten hergestellt. Die Menge der in jeder Reaktion verwendeten Matrize wird empirisch bestimmt und die Expression wird in parallelen Reaktionen überwacht, bei denen [35S]Methionin in den Rezeptor eingebaut wird, gefolgt von Gelelektrophorese und Exposition gegenüber Film. Bindungsreaktionen der Östrogenrezeptoren (ER) und Palomid 529 (P529) werden in einem Endvolumen von 100 µl in TEG-Puffer [10 mM Tris (pH 7.5), 1.5 mM EDTA, 10% Glycerin] durchgeführt. In jeder Bindungsreaktion wird in Gegenwart von 0.5 nM [3H]Estradiol (E2) 5 µl in vitro transkribierter und translatierter Rezeptor verwendet. Dieses Compound wird routinemäßig von 10−11 bis 10−6 M getestet und in Ethanol verdünnt. Die Reaktionen werden über Nacht bei 4 °C inkubiert und gebundenes E2 wird durch Zugabe von 200 µl Dextran-beschichteter Kohle quantifiziert. Nach 15-minütiger Rotation bei 4 °C werden die Röhrchen 10 Minuten lang zentrifugiert und 150 µl des Überstandes werden zu 5 ml Szintillationsmischung gegeben, um die cpm durch Flüssigszintillationszählung zu bestimmen. Die maximale Bindung wird durch Konkurrenz des gebundenen E2 mit nur dem Ethanol-Vehikel bestimmt. Kontrollen für den Hintergrund sind in jedem Experiment mit 5 µl unprogrammiertem Kaninchen-Retikulozytenlysat enthalten. Dieser Wert, typischerweise 10% bis 15% der maximalen Zählwerte, wird von allen Werten subtrahiert. Die Daten werden grafisch dargestellt und Ki-Werte berechnet. Die Experimente werden mindestens dreimal in Duplikaten durchgeführt.
|
|
| In vivo |
Palomid 529 (P529) zeigt nach seiner Behandlung eine dosisabhängige Hemmung der Ad-VEGF-A-getriebenen Angiogenese. Es hemmt das Wachstum von C6V10-Gliom-Tumoren in Nacktmäusen nach i.p.-Gabe und verringert die AktS473-, aber nicht die AktT308-Signalübertragung. Diese Verbindung hemmt auch das Tumorwachstum, die Angiogenese und die vaskuläre Permeabilität. Die Behandlung von PC-3-Tumor tragenden Mäusen damit reduzierte das Tumorwachstum im Vergleich zu Kontrollen um 57,1 %. Es ist ein wirksamer Suppressor der Müller-Zellproliferation, der Glianarbenbildung und des Photorezeptorzelltods in einem Kaninchenmodell der Netzhautablösung (RD). Palomid 529 unterdrückt signifikant das Wachstum Brca1-defizienter Tumoren in Mäusen durch Hemmung sowohl der Akt- als auch der mTOR-Signalübertragung. |
Literatur |
|
Technischer Support
Tel: +1-832-582-8158 Ext:3
Wenn Sie weitere Fragen haben, hinterlassen Sie bitte eine Nachricht.
