nur für Forschungszwecke
Ranolazine 2HCl Calcium Channel Inhibitor
Kat.-Nr.S1425
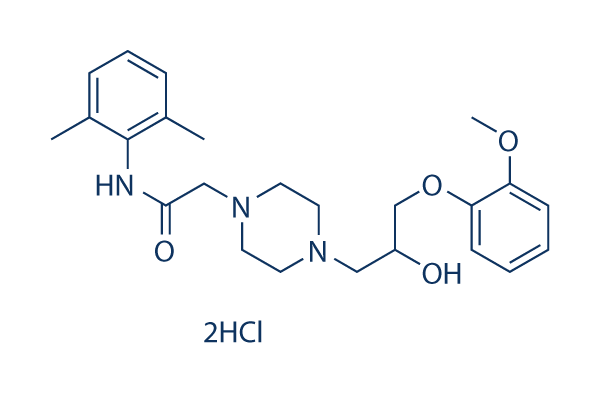
Chemische Struktur
Molekulargewicht: 500.46
Qualitätskontrolle
| Verwandte Ziele | CFTR CRM1 CD markers AChR Sodium Channel Potassium Channel GABA Receptor TRP Channel ATPase GluR |
|---|---|
| Weitere Calcium Channel Inhibitoren | Bay K 8644 Tetrandrine Nilvadipine Flunarizine 2HCl Cilnidipine YM-58483 (BTP2) Ionomycin Imperatorin Manidipine 2HCl Astragaloside A |
Chemische Informationen, Lagerung & Stabilität
| Molekulargewicht | 500.46 | Formel | C24H33N3O4.2HCl |
Lagerung (Ab dem Eingangsdatum) | |
|---|---|---|---|---|---|
| CAS-Nr. | 95635-56-6 | SDF herunterladen | Lagerung von Stammlösungen |
|
|
| Synonyme | RS-43285,RS 43285-193,Ranexa, renolazine,Ranolazine dihydrochloride | Smiles | CC1=C(C(=CC=C1)C)NC(=O)CN2CCN(CC2)CC(COC3=CC=CC=C3OC)O.Cl.Cl | ||
Löslichkeit
|
In vitro |
DMSO
: 100 mg/mL
(199.81 mM)
Water : Insoluble Ethanol : Insoluble |
Molaritätsrechner
|
In vivo |
|||||
In-vivo-Formulierungsrechner (Klare Lösung)
Schritt 1: Geben Sie die untenstehenden Informationen ein (Empfohlen: Ein zusätzliches Tier zur Berücksichtigung von Verlusten während des Experiments)
Schritt 2: Geben Sie die In-vivo-Formulierung ein (Dies ist nur der Rechner, keine Formulierung. Bitte kontaktieren Sie uns zuerst, wenn es im Abschnitt "Löslichkeit" keine In-vivo-Formulierung gibt.)
Berechnungsergebnisse:
Arbeitskonzentration: mg/ml;
Methode zur Herstellung der DMSO-Stammlösung: mg Wirkstoff vorgelöst in μL DMSO ( Konzentration der Stammlösung mg/mL, Bitte kontaktieren Sie uns zuerst, wenn die Konzentration die DMSO-Löslichkeit der Wirkstoffcharge überschreitet. )
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügenμL PEG300, mischen und klären, dann hinzufügenμL Tween 80, mischen und klären, dann hinzufügen μL ddH2O, mischen und klären.
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügen μL Maisöl, mischen und klären.
Hinweis: 1. Bitte stellen Sie sicher, dass die Flüssigkeit klar ist, bevor Sie das nächste Lösungsmittel hinzufügen.
2. Achten Sie darauf, das/die Lösungsmittel der Reihe nach hinzuzufügen. Sie müssen sicherstellen, dass die bei der vorherigen Zugabe erhaltene Lösung eine klare Lösung ist, bevor Sie mit der Zugabe des nächsten Lösungsmittels fortfahren. Physikalische Methoden wie Vortex, Ultraschall oder ein heißes Wasserbad können zur Unterstützung des Lösens verwendet werden.
Wirkmechanismus
| Targets/IC50/Ki |
Calcium channel
|
|---|---|
| In vitro |
Ranolazine hemmt selektiv das späte I(Na), reduziert die [Na(+)](i)-abhängige Calciumüberladung und mildert die Anomalien der ventrikulären Repolarisation und Kontraktilität, die mit Ischämie/Reperfusion und Herzinsuffizienz in Myokardzellen verbunden sind. Ranolazine verkürzt die Aktionspotentialdauer (APD) von Myozyten, die entweder mit 0,5 Hz oder 0,25 Hz stimuliert werden, in einer konzentrationsabhängigen Weise in linken ventrikulären Myozyten von Hunden signifikant und reversibel. Ranolazine verkürzt bei 5 und 10 mM die Dauer von Zuckungskontraktionen (TC) reversibel und eliminierte die Nachkontraktion. Ranolazine bindet stärker an den inaktivierten Zustand als an den Ruhezustand des Natriumkanals, der I(NaL) zugrunde liegt. |
| In vivo |
Ranolazine (10 mM) erhöht die Glukoseoxidation um das 1,5- bis 3-fache unter Bedingungen, bei denen der Beitrag von Glukose zur gesamten ATP-Produktion gering (niedriges Ca, hoher FA, mit Insulin), hoch (hohes Ca, niedriger FA, mit Pacing) oder intermediär in arbeitenden Herzen ist. Ranolazine erhöht die Glukoseoxidation in normoxischen Langendorff-Herzen (hohes Ca, niedriger FA; 15 ml/min) ähnlich. Ranolazine erhöht sie auch signifikant während der Flussreduktion auf 7 ml/min, 3 ml/min und 0,5 ml/min. Ranolazine verbessert das funktionelle Ergebnis signifikant, was mit signifikanten Erhöhungen der Glukoseoxidation, einer Umkehrung der erhöhten FA-Oxidation, die in Kontrollreperfusionen (im Vergleich zu präischämischen) beobachtet wurde, und einer kleineren, aber signifikanten Erhöhung der Glykolyse in reperfundierten ischämischen arbeitenden Herzen verbunden ist. |
Literatur |
|
Klinische Studieninformationen
(Daten von https://clinicaltrials.gov, aktualisiert am 2024-05-22)
| NCT-Nummer | Rekrutierung | Erkrankungen | Sponsor/Kooperationspartner | Startdatum | Phasen |
|---|---|---|---|---|---|
| NCT03486561 | Unknown status | Chronic Stable Angina |
OBS Pakistan |
April 1 2018 | Phase 4 |
| NCT03044964 | Unknown status | Angina |
Amit Malhotra MD|Gilead Sciences|Stern Cardiovascular Foundation Inc. |
January 10 2017 | Phase 4 |
| NCT02252406 | Completed | Stable Angina|Metabolic Syndrome |
University of Florida |
September 2015 | Phase 4 |
| NCT02360397 | Completed | Ventricular Premature Complexes|Myocardial Ischemia |
Kent Hospital Rhode Island|Gilead Sciences |
December 2014 | Phase 2 |
| NCT02156336 | Terminated | Diabetic Peripheral Neuropathic Pain |
Horizons International Peripheral Group|Gilead Sciences |
May 2014 | Phase 4 |
Technischer Support
Tel: +1-832-582-8158 Ext:3
Wenn Sie weitere Fragen haben, hinterlassen Sie bitte eine Nachricht.
