nur für Forschungszwecke
Toremifene Citrate (NK 622) Estrogen/progestogen Receptor Modulator
Kat.-Nr.S1776
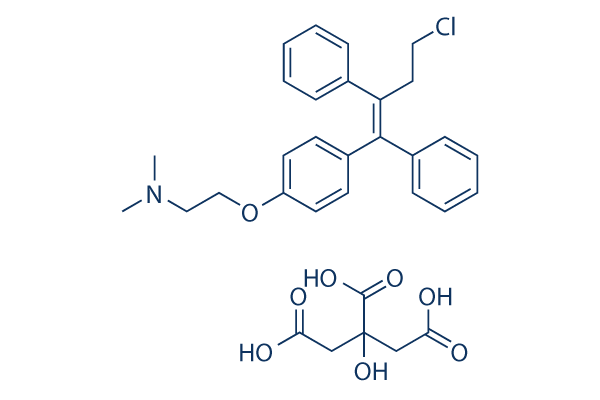
Chemische Struktur
Molekulargewicht: 598.08
Qualitätskontrolle
| Verwandte Ziele | Adrenergic Receptor GPR Androgen Receptor Glucocorticoid Receptor ACE RAAS Progesterone Receptor Opioid Receptor PGES THR |
|---|---|
| Weitere Estrogen/progestogen Receptor Inhibitoren | Elacestrant (RAD1901) Dihydrochloride Vepdegestrant (ARV-471) MPP dihydrochloride Kaempferol Cholesterol G15 Endoxifen HCl Licochalcone A Chrysin Pregnenolone |
Chemische Informationen, Lagerung & Stabilität
| Molekulargewicht | 598.08 | Formel | C32H36ClNO8 |
Lagerung (Ab dem Eingangsdatum) | |
|---|---|---|---|---|---|
| CAS-Nr. | 89778-27-8 | SDF herunterladen | Lagerung von Stammlösungen |
|
|
| Synonyme | NSC 613680,NK 622 Citrate | Smiles | CN(C)CCOC1=CC=C(C=C1)C(=C(CCCl)C2=CC=CC=C2)C3=CC=CC=C3.C(C(=O)O)C(CC(=O)O)(C(=O)O)O | ||
Löslichkeit
|
In vitro |
DMSO
: 100 mg/mL
(167.2 mM)
Water : Insoluble Ethanol : Insoluble |
Molaritätsrechner
|
In vivo |
|||||
In-vivo-Formulierungsrechner (Klare Lösung)
Schritt 1: Geben Sie die untenstehenden Informationen ein (Empfohlen: Ein zusätzliches Tier zur Berücksichtigung von Verlusten während des Experiments)
Schritt 2: Geben Sie die In-vivo-Formulierung ein (Dies ist nur der Rechner, keine Formulierung. Bitte kontaktieren Sie uns zuerst, wenn es im Abschnitt "Löslichkeit" keine In-vivo-Formulierung gibt.)
Berechnungsergebnisse:
Arbeitskonzentration: mg/ml;
Methode zur Herstellung der DMSO-Stammlösung: mg Wirkstoff vorgelöst in μL DMSO ( Konzentration der Stammlösung mg/mL, Bitte kontaktieren Sie uns zuerst, wenn die Konzentration die DMSO-Löslichkeit der Wirkstoffcharge überschreitet. )
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügenμL PEG300, mischen und klären, dann hinzufügenμL Tween 80, mischen und klären, dann hinzufügen μL ddH2O, mischen und klären.
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügen μL Maisöl, mischen und klären.
Hinweis: 1. Bitte stellen Sie sicher, dass die Flüssigkeit klar ist, bevor Sie das nächste Lösungsmittel hinzufügen.
2. Achten Sie darauf, das/die Lösungsmittel der Reihe nach hinzuzufügen. Sie müssen sicherstellen, dass die bei der vorherigen Zugabe erhaltene Lösung eine klare Lösung ist, bevor Sie mit der Zugabe des nächsten Lösungsmittels fortfahren. Physikalische Methoden wie Vortex, Ultraschall oder ein heißes Wasserbad können zur Unterstützung des Lösens verwendet werden.
Wirkmechanismus
| Targets/IC50/Ki |
Estrogen receptor
|
|---|---|
| In vitro |
Toremifene (7,5 mM) bewirkt, dass etwa 60 % der Zellen morphologische Merkmale zeigen, die typisch für Zellen sind, die einem programmierten Zelltod oder Apoptose in menschlichen Brustkrebszellen unterliegen. Toremifen (5-10 mM) führt zu erhöhten Spiegeln von TRPM-2- und TGF-beta-1-mRNAs in in vitro oder in vivo gewachsenen Tumorzellen. Toremifen hemmt das Wachstum östrogenempfindlicher Brustkrebszellen, indem es einige Zellen zur Apoptose anregt und andere Zellen am Eintritt in die Mitose hindert. Toremifen induziert eine dosisabhängige Adduktmenge, die geringer ist als die, die für TAM beobachtet wurde. Toremifen verstärkt signifikant die endogene DNA-Adduktbildung. Toremifen beeinflusst den Zellumsatz, indem es die mitotische Aktivität hemmt und die reichlich vorhandene spontane Apoptose im DMBA-induzierten Rattenmamakarzinom modifiziert.
|
| In vivo |
Toremifen erhöht bei der höchsten getesteten Dosis die Inzidenz von hepatozellulären Karzinomen in den DEN-initiierten Gruppen auf ein Drittel des Niveaus, das bei Tamoxifen-Verabreichung an DEN-initiierte Ratten beobachtet wurde. Toremifen erhöht die Inzidenz von Hypernephromen bei zuvor DEN-initiierten Ratten. Toremifen führt zu Aneuploidie bei 50 % der untersuchten Zellen, verglichen mit dem von Tamoxifen induzierten Niveau von 85 % bei weiblichen Sprague-Dawley-Ratten.
|
Literatur |
|
Klinische Studieninformationen
(Daten von https://clinicaltrials.gov, aktualisiert am 2024-05-22)
| NCT-Nummer | Rekrutierung | Erkrankungen | Sponsor/Kooperationspartner | Startdatum | Phasen |
|---|---|---|---|---|---|
| NCT01214291 | Withdrawn | Risk of Bone Fracture Occurrences |
GTx|Ipsen |
March 2011 | Phase 3 |
| NCT00267553 | Terminated | Breast Neoplasms|Neoplasms Hormone-Dependent |
Intarcia Therapeutics |
November 2005 | Phase 3 |
| NCT00106691 | Completed | Preneoplastic Conditions|Prostatic Intraepithelial Neoplasia |
GTx |
January 2005 | Phase 3 |
Technischer Support
Tel: +1-832-582-8158 Ext:3
Wenn Sie weitere Fragen haben, hinterlassen Sie bitte eine Nachricht.
