nur für Forschungszwecke
ARS-1620 KRas Inhibitor
Kat.-Nr.S8707
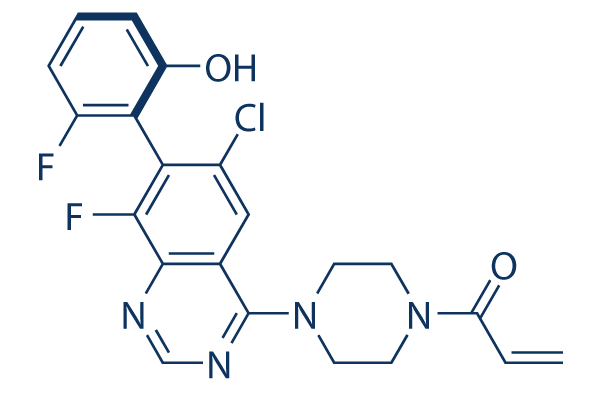
Chemische Struktur
Molekulargewicht: 430.84
Qualitätskontrolle
| Verwandte Ziele | CDK HSP PD-1/PD-L1 ROCK Wee1 DNA/RNA Synthesis Microtubule Associated Ras Aurora Kinase Casein Kinase |
|---|---|
| Weitere KRas Inhibitoren | RMC-7977 Daraxonrasib (RMC-6236) MRTX1133 Zoldonrasib (RMC-9805) BI-2852 Adagrasib (MRTX849) HRS-4642 BI-3406 ARS-853 BAY-293 |
Chemische Informationen, Lagerung & Stabilität
| Molekulargewicht | 430.84 | Formel | C21H17ClF2N4O2 |
Lagerung (Ab dem Eingangsdatum) | 3 years -20°C powder |
|---|---|---|---|---|---|
| CAS-Nr. | 1698055-85-4 | -- | Lagerung von Stammlösungen |
|
|
| Synonyme | N/A | Smiles | C=CC(=O)N1CCN(CC1)C2=NC=NC3=C(C(=C(C=C32)Cl)C4=C(C=CC=C4F)O)F | ||
Löslichkeit
|
In vitro |
DMSO
: 86 mg/mL
(199.61 mM)
Ethanol : 86 mg/mL Water : Insoluble |
Molaritätsrechner
|
In vivo |
|||||
In-vivo-Formulierungsrechner (Klare Lösung)
Schritt 1: Geben Sie die untenstehenden Informationen ein (Empfohlen: Ein zusätzliches Tier zur Berücksichtigung von Verlusten während des Experiments)
Schritt 2: Geben Sie die In-vivo-Formulierung ein (Dies ist nur der Rechner, keine Formulierung. Bitte kontaktieren Sie uns zuerst, wenn es im Abschnitt "Löslichkeit" keine In-vivo-Formulierung gibt.)
Berechnungsergebnisse:
Arbeitskonzentration: mg/ml;
Methode zur Herstellung der DMSO-Stammlösung: mg Wirkstoff vorgelöst in μL DMSO ( Konzentration der Stammlösung mg/mL, Bitte kontaktieren Sie uns zuerst, wenn die Konzentration die DMSO-Löslichkeit der Wirkstoffcharge überschreitet. )
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügenμL PEG300, mischen und klären, dann hinzufügenμL Tween 80, mischen und klären, dann hinzufügen μL ddH2O, mischen und klären.
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügen μL Maisöl, mischen und klären.
Hinweis: 1. Bitte stellen Sie sicher, dass die Flüssigkeit klar ist, bevor Sie das nächste Lösungsmittel hinzufügen.
2. Achten Sie darauf, das/die Lösungsmittel der Reihe nach hinzuzufügen. Sie müssen sicherstellen, dass die bei der vorherigen Zugabe erhaltene Lösung eine klare Lösung ist, bevor Sie mit der Zugabe des nächsten Lösungsmittels fortfahren. Physikalische Methoden wie Vortex, Ultraschall oder ein heißes Wasserbad können zur Unterstützung des Lösens verwendet werden.
Wirkmechanismus
| Targets/IC50/Ki |
K-Ras(G12C)
|
|---|---|
| In vitro |
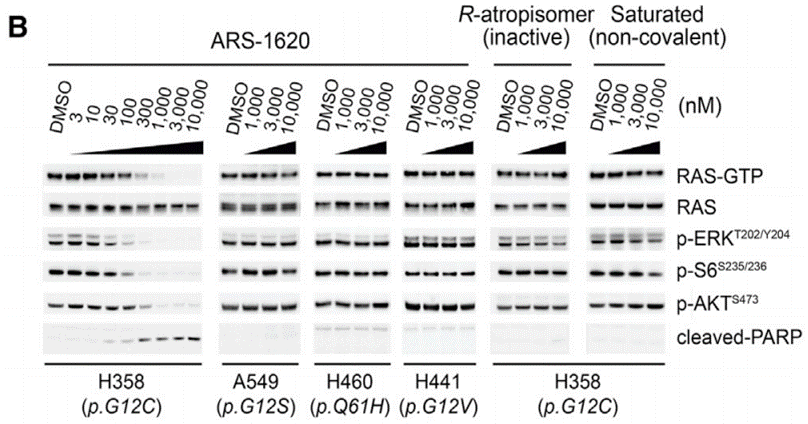
ARS-1620 hemmt die KRAS (G12C)-Aktivität mit hoher Potenz und atropisomerer Selektivität in p.G12C-mutierten Krebszellen kovalent. Diese Verbindung band G12C schnell konzentrations- und zeitabhängig, was mit ihrem kovalenten Hemmmechanismus übereinstimmt. Über eine Reihe von Zelllinien, die das mutierte Allel beherbergten, zeigte sie nach 2 Stunden Behandlung eine halbmaximale G12C-Zielbindung (TE50) bei ~0,3 μM und eine nahezu vollständige Bindung bei 3,0 μM. Diese Chemikalie hemmt RAS-GTP und die Phosphorylierung von MEK, ERK, RSK, S6 und AKT dosisabhängig und selektiv in H358 (p.G12C), aber nicht in negativen Kontroll-Lungenkrebszelllinien ohne p.G12C (A549, H460 und H441). Sie bewirkt eine submikromolare allelspezifische Potenz (IC50 = 0,3 μM; IC90 = 1 μM). Die Aktivität dieser Verbindung ist spezifisch für das G12C-Allel und wird durch die kovalente Modifikation von Cys-12 vermittelt. |
| In vivo |
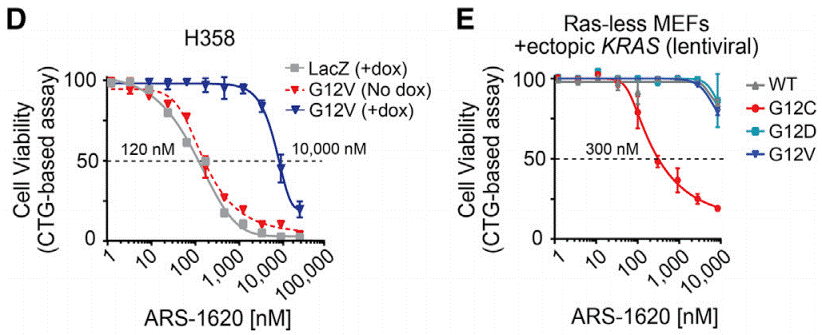
ARS-1620 weist bei Mäusen eine ausgezeichnete orale Bioverfügbarkeit (F > 60 %) auf. In MIA-PaCa2-Xenotransplantaten (p.G12C) hemmt diese Verbindung das Tumorwachstum (p < 0,001) dosisabhängig signifikant, mit einer deutlichen Regression bei einer einmal täglichen Dosis von 200 mg/kg. Xenotransplantate von H441 (p.G12V) zeigen bei allen getesteten Dosen keine Reaktion, und das R-Atropisomer dieser Chemikalie zeigt in beiden Modellen keine Aktivität. Es induziert selektiv die Tumorregression in patientenabgeleiteten Tumormodellen (die KRAS p.G12C beherbergen). |
Literatur |
Anwendungen
| Methoden | Biomarker | Bilder | PMID |
|---|---|---|---|
| Western blot | RAS-GTP / RAS / pERK / p-S6 / p-AKT / Cleaved-PARP |
|
29373830 |
| Growth inhibition assay | Cell viability |
|
29373830 |
Technischer Support
Tel: +1-832-582-8158 Ext:3
Wenn Sie weitere Fragen haben, hinterlassen Sie bitte eine Nachricht.
