nur für Forschungszwecke
Diazoxide ADC Cytotoxin Inhibitor
Kat.-Nr.S4630
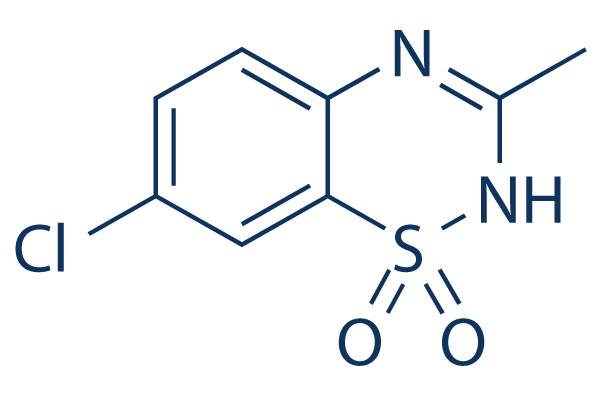
Chemische Struktur
Molekulargewicht: 230.67
Qualitätskontrolle
| Verwandte Ziele | CFTR CRM1 CD markers AChR Calcium Channel Sodium Channel Potassium Channel GABA Receptor TRP Channel ATPase |
|---|---|
| Weitere ADC Cytotoxin Inhibitoren | Triptolide SN-38 Luteolin (+)-Bicuculline Rutin Artemisinin BHQ Pinocembrin Harmine hydrochloride Luteoloside |
Chemische Informationen, Lagerung & Stabilität
| Molekulargewicht | 230.67 | Formel | C8H7ClN2O2S |
Lagerung (Ab dem Eingangsdatum) | |
|---|---|---|---|---|---|
| CAS-Nr. | 364-98-7 | SDF herunterladen | Lagerung von Stammlösungen |
|
|
| Synonyme | Sch-6783, SRG-95213 | Smiles | CC1=NS(=O)(=O)C2=C(N1)C=CC(=C2)Cl | ||
Löslichkeit
|
In vitro |
DMSO
: 46 mg/mL
(199.41 mM)
Water : Insoluble Ethanol : Insoluble |
Molaritätsrechner
|
In vivo |
|||||
In-vivo-Formulierungsrechner (Klare Lösung)
Schritt 1: Geben Sie die untenstehenden Informationen ein (Empfohlen: Ein zusätzliches Tier zur Berücksichtigung von Verlusten während des Experiments)
Schritt 2: Geben Sie die In-vivo-Formulierung ein (Dies ist nur der Rechner, keine Formulierung. Bitte kontaktieren Sie uns zuerst, wenn es im Abschnitt "Löslichkeit" keine In-vivo-Formulierung gibt.)
Berechnungsergebnisse:
Arbeitskonzentration: mg/ml;
Methode zur Herstellung der DMSO-Stammlösung: mg Wirkstoff vorgelöst in μL DMSO ( Konzentration der Stammlösung mg/mL, Bitte kontaktieren Sie uns zuerst, wenn die Konzentration die DMSO-Löslichkeit der Wirkstoffcharge überschreitet. )
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügenμL PEG300, mischen und klären, dann hinzufügenμL Tween 80, mischen und klären, dann hinzufügen μL ddH2O, mischen und klären.
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügen μL Maisöl, mischen und klären.
Hinweis: 1. Bitte stellen Sie sicher, dass die Flüssigkeit klar ist, bevor Sie das nächste Lösungsmittel hinzufügen.
2. Achten Sie darauf, das/die Lösungsmittel der Reihe nach hinzuzufügen. Sie müssen sicherstellen, dass die bei der vorherigen Zugabe erhaltene Lösung eine klare Lösung ist, bevor Sie mit der Zugabe des nächsten Lösungsmittels fortfahren. Physikalische Methoden wie Vortex, Ultraschall oder ein heißes Wasserbad können zur Unterstützung des Lösens verwendet werden.
Wirkmechanismus
| Targets/IC50/Ki |
KATP channels
|
|---|---|
| In vitro |
Diazoxide hemmt die entzündliche Aktivität von Mikroglia. Diese Verbindungsinhibierung hemmt teilweise das durch LPS/IFN-γ in Mikrogliazellen induzierte Entzündungsmuster, wodurch eine Abnahme der NO-Produktion induziert wird, die auf die verringerte Expression von nachgewiesenem iNOS zurückzuführen sein könnte. Es hat keine Wirkung auf die Mikroglia-Phagozytose.
|
| In vivo |
Diazoxide ist vorteilhaft für die Verbesserung kognitiver Aufgaben, die Reduzierung von Angstzuständen, die Abnahme der Akkumulation von Amyloid-Beta-Oligomeren und die Hyperphosphorylierung von Tau-Proteinen. Diese Verbindung kann auch neuroprotektive Wirkungen unabhängig von der K+-Kanalaktivierung ausüben, indem sie die neuronale Erregbarkeit und die Aktivierung von N-Methyl-D-Aspartat (NMDA)-Rezeptoren verringert oder die Ströme durch α-Amino-3-hydroxy-5-methyl-4-isoxazolpropionsäure (AMPA)-Rezeptoren erhöht. Mit dieser Chemikalie behandelte Tiere zeigen einige Tage nach den ersten klinischen Anzeichen, die der akuten Entzündungsphase der Krankheit entsprechen, eine Abnahme der Krankheitsintensität. Die tägliche orale Verabreichung dieser Verbindung an EAE-Mäuse während der Effektorphase der Krankheit reduziert die Schwere der klinischen Anzeichen ohne offensichtliche Nebenwirkungen. Es verringert Demyelinisierung und axonalen Verlust, reduziert Gewebeschäden, hemmt die mikrogliale/Makrophagen- und Astrozytenaktivierung und bewahrt die Neuronenintegrität. Es werden keine Auswirkungen auf die Anzahl der B- und T-Lymphozyten beobachtet, die das Rückenmark infiltrieren.
|
Literatur |
|
Klinische Studieninformationen
(Daten von https://clinicaltrials.gov, aktualisiert am 2024-05-22)
| NCT-Nummer | Rekrutierung | Erkrankungen | Sponsor/Kooperationspartner | Startdatum | Phasen |
|---|---|---|---|---|---|
| NCT03941236 | Active not recruiting | Congenital Hyperinsulinism |
Zealand Pharma |
May 1 2019 | Phase 3 |
| NCT00901823 | Withdrawn | Hypertriglyceridemia |
Essentialis Inc. |
March 2011 | Phase 1 |
| NCT00696475 | Completed | Hypertriglyceridemia |
Essentialis Inc.|Medpace Inc. |
June 2008 | Phase 2 |
| NCT00688857 | Completed | Hypertriglyceridemia |
Essentialis Inc.|Cetero Research San Antonio |
May 2008 | Phase 1 |
Technischer Support
Tel: +1-832-582-8158 Ext:3
Wenn Sie weitere Fragen haben, hinterlassen Sie bitte eine Nachricht.
