nur für Forschungszwecke
Harmine hydrochloride ADC Cytotoxin chemisch
Kat.-Nr.S3817
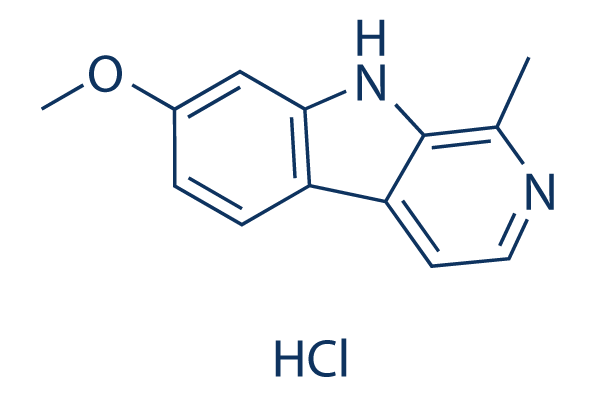
Chemische Struktur
Molekulargewicht: 248.71
Qualitätskontrolle
| Verwandte Ziele | CDK HSP PD-1/PD-L1 ROCK Wee1 DNA/RNA Synthesis Microtubule Associated Ras KRas Aurora Kinase |
|---|---|
| Weitere ADC Cytotoxin Inhibitoren | Triptolide SN-38 Luteolin (+)-Bicuculline Rutin Artemisinin BHQ Pinocembrin Luteoloside Sacituzumab-govitecan |
Chemische Informationen, Lagerung & Stabilität
| Molekulargewicht | 248.71 | Formel | C13H12N2O.HCl |
Lagerung (Ab dem Eingangsdatum) | |
|---|---|---|---|---|---|
| CAS-Nr. | 343-27-1 | SDF herunterladen | Lagerung von Stammlösungen |
|
|
| Synonyme | Telepathine hydrochloride | Smiles | CC1=NC=CC2=C1NC3=C2C=CC(=C3)OC.Cl | ||
Löslichkeit
|
In vitro |
|
Molaritätsrechner
|
In vivo |
|||||
In-vivo-Formulierungsrechner (Klare Lösung)
Schritt 1: Geben Sie die untenstehenden Informationen ein (Empfohlen: Ein zusätzliches Tier zur Berücksichtigung von Verlusten während des Experiments)
Schritt 2: Geben Sie die In-vivo-Formulierung ein (Dies ist nur der Rechner, keine Formulierung. Bitte kontaktieren Sie uns zuerst, wenn es im Abschnitt "Löslichkeit" keine In-vivo-Formulierung gibt.)
Berechnungsergebnisse:
Arbeitskonzentration: mg/ml;
Methode zur Herstellung der DMSO-Stammlösung: mg Wirkstoff vorgelöst in μL DMSO ( Konzentration der Stammlösung mg/mL, Bitte kontaktieren Sie uns zuerst, wenn die Konzentration die DMSO-Löslichkeit der Wirkstoffcharge überschreitet. )
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügenμL PEG300, mischen und klären, dann hinzufügenμL Tween 80, mischen und klären, dann hinzufügen μL ddH2O, mischen und klären.
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügen μL Maisöl, mischen und klären.
Hinweis: 1. Bitte stellen Sie sicher, dass die Flüssigkeit klar ist, bevor Sie das nächste Lösungsmittel hinzufügen.
2. Achten Sie darauf, das/die Lösungsmittel der Reihe nach hinzuzufügen. Sie müssen sicherstellen, dass die bei der vorherigen Zugabe erhaltene Lösung eine klare Lösung ist, bevor Sie mit der Zugabe des nächsten Lösungsmittels fortfahren. Physikalische Methoden wie Vortex, Ultraschall oder ein heißes Wasserbad können zur Unterstützung des Lösens verwendet werden.
Wirkmechanismus
| Targets/IC50/Ki |
DYRK1A
(Cell-free assay) 33 nM
MNB
(Cell-free assay) 149 nM
DYRK1B
(Cell-free assay) 166 nM
DYRK2
(Cell-free assay) 1.9 μM
|
|---|---|
| In vitro |
Harmine hemmt die Substratphosphorylierung durch DYRK1A stärker als die Substratphosphorylierung durch die eng verwandte Kinase DYRK1B [halbmaximale Hemmkonzentrationen (IC50) von 33 nM bzw. 166 nM] und durch die entfernteren Mitglieder der Familie, DYRK2 und DYRK4 (1,9 μM bzw. 80 μM). Viel höhere Harmine-Konzentrationen sind erforderlich, um die Tyrosin-Autophosphorylierung des translationalen Intermediats von DYRK1A in einem bakteriellen In-vitro-Translationssystem zu unterdrücken (IC50 = 1,9 μM). Harmine hemmt die Phosphorylierung eines spezifischen Substrats durch DYRK1A in kultivierten Zellen mit einer ähnlichen Potenz wie in vitro beobachtet (IC50 = 48 nM), ohne negative Auswirkungen auf die Viabilität der Zellen. Harmine hemmt die Tyrosin-Autophosphorylierung von DYRK1A in HEK293-Zellen nicht. Harmine ist in der Lage, die Proliferation von Betazellen zu induzieren, die Inselmasse zu erhöhen und die glykämische Kontrolle zu verbessern. Es ist ein ZNS-Stimulans. |
| In vivo |
In einem Modell der partiellen Pankreatektomie (PPX) induziert die Harmine-Behandlung eine Ki-67-Markierung in Betazellen sowohl bei scheinoperierten Mäusen als auch bei Mäusen, die einer PPX unterzogen wurden, wobei die robusteste Proliferation in den Betazellen von Harmine-behandelten PPX-Mäusen auftritt. Im PPX-Modell ist die Regeneration der Betazellmasse bei den Harmine-behandelten Mäusen wesentlich schneller als bei den Kontrollen und erreicht in nur 14 Tagen nahezu normale Werte. In einem euglykämen, nicht-adipösen, kombinierten Immundefizienz (NOD-SCID)-Mausmodell ist die BrdU- und Ki-67-Markierung in menschlichen Betazellen, die in die Nierenkapsel von Harmine-behandelten Mäusen im Vergleich zu Kontroll-euglykämen Mäusen transplantiert wurden, zwei- bis dreimal höher, ohne Anzeichen von Betazelltod. In einem marginalen Massen-Inseltransplantationsmodell beim Menschen in Streptozotocin-diabetischen NOD-SCID-Mäusen führt die Harmine-Behandlung auch zu einer nahezu normalen glykämischen Kontrolle. Harmine induziert die Produktion der wichtigen Betazell-Transkriptionsfaktoren NKX6.1, PDX1 und MAFA. |
Literatur |
|
Technischer Support
Tel: +1-832-582-8158 Ext:3
Wenn Sie weitere Fragen haben, hinterlassen Sie bitte eine Nachricht.
