nur für Forschungszwecke
Medroxyprogesterone Estrogen/progestogen Receptor Agonist
Kat.-Nr.S3635
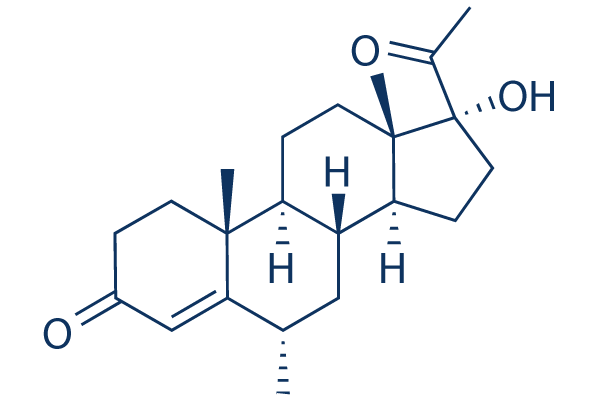
Chemische Struktur
Molekulargewicht: 344.49
Qualitätskontrolle
| Verwandte Ziele | Adrenergic Receptor GPR Androgen Receptor Glucocorticoid Receptor ACE RAAS Progesterone Receptor Opioid Receptor PGES THR |
|---|---|
| Weitere Estrogen/progestogen Receptor Inhibitoren | Elacestrant (RAD1901) Dihydrochloride Vepdegestrant (ARV-471) MPP dihydrochloride Kaempferol Cholesterol G15 Endoxifen HCl Licochalcone A Chrysin Pregnenolone |
Chemische Informationen, Lagerung & Stabilität
| Molekulargewicht | 344.49 | Formel | C22H32O3 |
Lagerung (Ab dem Eingangsdatum) | |
|---|---|---|---|---|---|
| CAS-Nr. | 520-85-4 | SDF herunterladen | Lagerung von Stammlösungen |
|
|
| Synonyme | MP | Smiles | CC1CC2C(CCC3(C2CCC3(C(=O)C)O)C)C4(C1=CC(=O)CC4)C | ||
Löslichkeit
|
In vitro |
DMSO
: 68 mg/mL
(197.39 mM)
Ethanol : 14 mg/mL Water : Insoluble |
Molaritätsrechner
|
In vivo |
|||||
In-vivo-Formulierungsrechner (Klare Lösung)
Schritt 1: Geben Sie die untenstehenden Informationen ein (Empfohlen: Ein zusätzliches Tier zur Berücksichtigung von Verlusten während des Experiments)
Schritt 2: Geben Sie die In-vivo-Formulierung ein (Dies ist nur der Rechner, keine Formulierung. Bitte kontaktieren Sie uns zuerst, wenn es im Abschnitt "Löslichkeit" keine In-vivo-Formulierung gibt.)
Berechnungsergebnisse:
Arbeitskonzentration: mg/ml;
Methode zur Herstellung der DMSO-Stammlösung: mg Wirkstoff vorgelöst in μL DMSO ( Konzentration der Stammlösung mg/mL, Bitte kontaktieren Sie uns zuerst, wenn die Konzentration die DMSO-Löslichkeit der Wirkstoffcharge überschreitet. )
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügenμL PEG300, mischen und klären, dann hinzufügenμL Tween 80, mischen und klären, dann hinzufügen μL ddH2O, mischen und klären.
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügen μL Maisöl, mischen und klären.
Hinweis: 1. Bitte stellen Sie sicher, dass die Flüssigkeit klar ist, bevor Sie das nächste Lösungsmittel hinzufügen.
2. Achten Sie darauf, das/die Lösungsmittel der Reihe nach hinzuzufügen. Sie müssen sicherstellen, dass die bei der vorherigen Zugabe erhaltene Lösung eine klare Lösung ist, bevor Sie mit der Zugabe des nächsten Lösungsmittels fortfahren. Physikalische Methoden wie Vortex, Ultraschall oder ein heißes Wasserbad können zur Unterstützung des Lösens verwendet werden.
Wirkmechanismus
| In vitro |
Medroxyprogesteroneacetat (MPA, 10 nM)-Behandlung über 48 h induziert die Proliferation der Zellen (1,6-fache Induktion). MPA induziert die Cyclin D1-Expression (3,3-fache Induktion). MPA erhöht sowohl den Proteingehalt (2,2-fache Induktion) als auch die Promotoraktivität (2,7-fache Induktion) von Cyclin D1 in MCF-7-Zellen, die mit PRB, aber nicht mit PRA transfiziert wurden. Obwohl MPA die Cyclin D1-Expression transkriptionell aktiviert, weist der Cyclin D1-Promotor keine Progesteron-responsive Element-bezogene Sequenz auf. MPA induziert die transiente Phosphorylierung von Akt (2,7-fache Induktion nach 5 min) und auch die Phosphorylierung des Inhibitors von NFkappaBalpha (IkappaBalpha) (2,3-fache Induktion). MPA aktiviert Glucocorticoidrezeptoren, was einen Teil der antiatherosklerotischen Effekte von Glucocorticoiden nachahmen könnte, und hat andererseits auch antiandrogene Aktivität, die schützende Östrogeneffekte verringern könnte.
|
|---|---|
| In vivo |
Eine Langzeitbehandlung mit MPA und MPA + E2 erhöht die arterielle Thrombose trotz der hemmenden Effekte von MPA auf die Atherosklerose bei ApoE-defizienten Mäusen. Eine erhöhte Thrombinbildung, ein reduzierter Gehalt an glatter Muskulatur und eine Umgestaltung der nicht-kollagenen Plaque-Matrix könnten an den prothrombotischen Effekten beteiligt sein. Somit zeigt MPA unterschiedliche Effekte auf die arterielle Thrombose und auf die Atherosklerose. Bei Affen stört MPA die antiatherosklerotischen Östrogeneffekte, während Progesteron dies nicht tut.
|
Literatur |
|
Klinische Studieninformationen
(Daten von https://clinicaltrials.gov, aktualisiert am 2024-05-22)
| NCT-Nummer | Rekrutierung | Erkrankungen | Sponsor/Kooperationspartner | Startdatum | Phasen |
|---|---|---|---|---|---|
| NCT05188222 | Not yet recruiting | Left Ventricular Dysfunction|Quality of Recovery|Right Ventricular Dysfunction |
Jewish General Hospital |
September 1 2024 | Phase 4 |
| NCT06325293 | Not yet recruiting | Community Acquired Pneumonia in Children|Mycoplasma Pneumoniae|Mycoplasma Pneumoniae Pneumonia |
Christoph Berger|University Children''s Hospital Zurich |
July 1 2024 | Not Applicable |
Technischer Support
Tel: +1-832-582-8158 Ext:3
Wenn Sie weitere Fragen haben, hinterlassen Sie bitte eine Nachricht.
