nur für Forschungszwecke
NU1025 PARP Inhibitor
Kat.-Nr.S7730
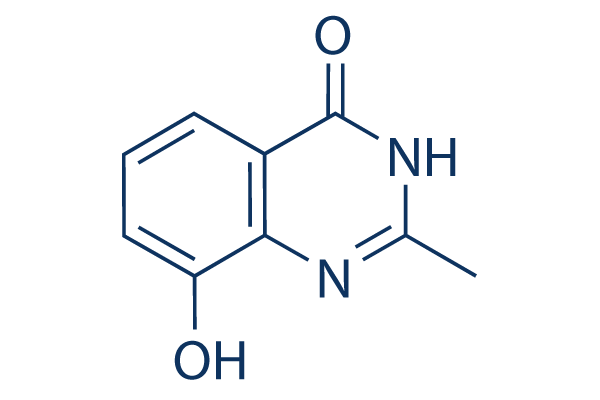
Chemische Struktur
Molekulargewicht: 176.17
Qualitätskontrolle
| Verwandte Ziele | HDAC ATM/ATR DNA-PK WRN DNA/RNA Synthesis Topoisomerase PPAR Sirtuin Casein Kinase eIF |
|---|---|
| Weitere PARP Inhibitoren | XAV-939 AZD5305 (Saruparib) Veliparib (ABT-888) PJ34 HCl AG-14361 Iniparib (BSI-201) G007-LK Pamiparib UPF 1069 A-966492 |
Chemische Informationen, Lagerung & Stabilität
| Molekulargewicht | 176.17 | Formel | C9H8N2O2 |
Lagerung (Ab dem Eingangsdatum) | |
|---|---|---|---|---|---|
| CAS-Nr. | 90417-38-2 | SDF herunterladen | Lagerung von Stammlösungen |
|
|
| Synonyme | NSC 696807 | Smiles | CC1=NC2=C(C=CC=C2O)C(=O)N1 | ||
Löslichkeit
|
In vitro |
DMSO
: 35 mg/mL
(198.67 mM)
Ethanol : 6 mg/mL Water : Insoluble |
Molaritätsrechner
|
In vivo |
|||||
In-vivo-Formulierungsrechner (Klare Lösung)
Schritt 1: Geben Sie die untenstehenden Informationen ein (Empfohlen: Ein zusätzliches Tier zur Berücksichtigung von Verlusten während des Experiments)
Schritt 2: Geben Sie die In-vivo-Formulierung ein (Dies ist nur der Rechner, keine Formulierung. Bitte kontaktieren Sie uns zuerst, wenn es im Abschnitt "Löslichkeit" keine In-vivo-Formulierung gibt.)
Berechnungsergebnisse:
Arbeitskonzentration: mg/ml;
Methode zur Herstellung der DMSO-Stammlösung: mg Wirkstoff vorgelöst in μL DMSO ( Konzentration der Stammlösung mg/mL, Bitte kontaktieren Sie uns zuerst, wenn die Konzentration die DMSO-Löslichkeit der Wirkstoffcharge überschreitet. )
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügenμL PEG300, mischen und klären, dann hinzufügenμL Tween 80, mischen und klären, dann hinzufügen μL ddH2O, mischen und klären.
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügen μL Maisöl, mischen und klären.
Hinweis: 1. Bitte stellen Sie sicher, dass die Flüssigkeit klar ist, bevor Sie das nächste Lösungsmittel hinzufügen.
2. Achten Sie darauf, das/die Lösungsmittel der Reihe nach hinzuzufügen. Sie müssen sicherstellen, dass die bei der vorherigen Zugabe erhaltene Lösung eine klare Lösung ist, bevor Sie mit der Zugabe des nächsten Lösungsmittels fortfahren. Physikalische Methoden wie Vortex, Ultraschall oder ein heißes Wasserbad können zur Unterstützung des Lösens verwendet werden.
Wirkmechanismus
| Targets/IC50/Ki |
PARP
400 nM
|
|---|---|
| In vitro |
Die Behandlung mit NU1025 (0,2 mM) schwächt die H2O2-induzierte Zytotoxizität ab. Diese Verbindung allein hat keine Auswirkungen auf die Zellviabilität. Ihre Vorbehandlung erhöht die Zellviabilität (82,59 ± 4,67 %) in SIN-1 (0,8 mM) exponierten Zellen signifikant. Sie hat keine nachweisbaren Auswirkungen auf die Proliferation von D54- und U251-Zellen. Die Behandlung mit dieser Chemikalie hemmt die durch TPT- und RT-Behandlung verstärkte Aktivierung von PARP-1 deutlich. Nach Exposition mit 200 µM dieser Verbindung allein wird kein DNA-Strangbruch nachgewiesen.
|
| Kinase-Assay |
PARP-Aktivierungsassay
|
|
Zellen werden in hypotonem Puffer (9 mM HEPES, pH 7,8, 4,5 % (v/v) Dextran, 4,5 mM MgCl2 und 5 mM DTT) bei 1,5 × 107/mL auf Eis 30 min suspendiert, dann werden 9 Volumina isotoner Puffer (40 mM HEPES, pH 7,8, 130 mM KCl, 4 % (v/v) Dextran, 2 mM EGTA, 2,3 mM MgCl2, 225 mM Saccharose und 2,5 mM DTT) hinzugefügt. Die Reaktion wird durch Zugabe von 300 µL Zellen zu 100 µL 300 µM NAD+ mit [32P]-NAD+ gestartet und durch Zugabe von 2 mL eiskaltem 10 % (w/v) TCA + 10 % (w/v) Natriumpyrophosphat beendet. Nach 30 min auf Eis werden die präzipitierten 32P-markierten ADP-Ribose-Polymere filtriert, fünfmal mit 1 % (v/v) TCA, 1 % (v/v) Natriumpyrophosphat gewaschen, getrocknet und gezählt.
|
|
| In vivo |
Die Behandlung mit NU1025 (1 und 3 mg/kg) reduziert den Infarkt auf 25 % bzw. 45 % im Vergleich zu Vehikel-behandelten Ratten. Die Behandlung mit dieser Verbindung (1 und 3 mg/kg) reduziert das Ödemvolumen signifikant. Sie führt auch zu einer signifikanten Verbesserung der neurologischen Defizite.
|
Literatur |
|
Technischer Support
Tel: +1-832-582-8158 Ext:3
Wenn Sie weitere Fragen haben, hinterlassen Sie bitte eine Nachricht.
