nur für Forschungszwecke
Rhodamine 123 ATPase Inhibitor
Kat.-Nr.S3577
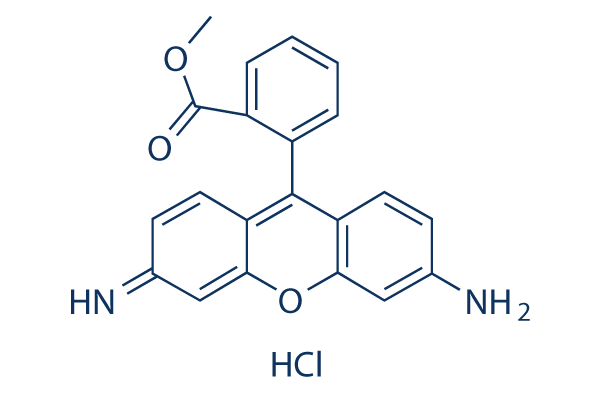
Chemische Struktur
Molekulargewicht: 380.82
Qualitätskontrolle
- In Nature Medicine für seine erstklassige Qualität zitiert
- COA
- SDS
- Datenblatt
| Verwandte Ziele | CFTR CRM1 CD markers AChR Calcium Channel Sodium Channel Potassium Channel GABA Receptor TRP Channel GluR |
|---|---|
| Weitere ATPase Inhibitoren | (-)-Blebbistatin Thapsigargin Brefeldin A (BFA chemical) CB-5083 Golgicide A Sodium orthovanadate Oleic Acid Bufalin Ginsenoside Rb1 CDN1163 |
Chemische Informationen, Lagerung & Stabilität
| Molekulargewicht | 380.82 | Formel | C21H17ClN2O3
|
Lagerung (Ab dem Eingangsdatum) | 3 years -20°C powder |
|---|---|---|---|---|---|
| CAS-Nr. | 62669-70-9 | -- | Lagerung von Stammlösungen |
|
|
| Synonyme | RH-123, R-22420 | Smiles | Cl.COC(=O)C1=CC=CC=C1C2=C3C=CC(=N)C=C3OC4=C2C=CC(=C4)N | ||
Löslichkeit
|
In vitro |
DMSO
: 76 mg/mL
(199.56 mM)
Ethanol : 15 mg/mL Water : Insoluble |
Molaritätsrechner
|
In vivo |
|||||
In-vivo-Formulierungsrechner (Klare Lösung)
Schritt 1: Geben Sie die untenstehenden Informationen ein (Empfohlen: Ein zusätzliches Tier zur Berücksichtigung von Verlusten während des Experiments)
Schritt 2: Geben Sie die In-vivo-Formulierung ein (Dies ist nur der Rechner, keine Formulierung. Bitte kontaktieren Sie uns zuerst, wenn es im Abschnitt "Löslichkeit" keine In-vivo-Formulierung gibt.)
Berechnungsergebnisse:
Arbeitskonzentration: mg/ml;
Methode zur Herstellung der DMSO-Stammlösung: mg Wirkstoff vorgelöst in μL DMSO ( Konzentration der Stammlösung mg/mL, Bitte kontaktieren Sie uns zuerst, wenn die Konzentration die DMSO-Löslichkeit der Wirkstoffcharge überschreitet. )
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügenμL PEG300, mischen und klären, dann hinzufügenμL Tween 80, mischen und klären, dann hinzufügen μL ddH2O, mischen und klären.
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügen μL Maisöl, mischen und klären.
Hinweis: 1. Bitte stellen Sie sicher, dass die Flüssigkeit klar ist, bevor Sie das nächste Lösungsmittel hinzufügen.
2. Achten Sie darauf, das/die Lösungsmittel der Reihe nach hinzuzufügen. Sie müssen sicherstellen, dass die bei der vorherigen Zugabe erhaltene Lösung eine klare Lösung ist, bevor Sie mit der Zugabe des nächsten Lösungsmittels fortfahren. Physikalische Methoden wie Vortex, Ultraschall oder ein heißes Wasserbad können zur Unterstützung des Lösens verwendet werden.
Wirkmechanismus
| Targets/IC50/Ki |
ATPase
(inverted inner membrane vesicles) 126 μM(Ki)
F1-ATPase
(Cell-free assay) 177 μM(Ki)
|
|---|---|
| In vitro |
1. Herstellung der Rhodamine 123 Arbeitslösung |
Literatur |
|
Technischer Support
Tel: +1-832-582-8158 Ext:3
Wenn Sie weitere Fragen haben, hinterlassen Sie bitte eine Nachricht.
