nur für Forschungszwecke
BMN-673 (Talazoparib) PARP Inhibitor
Kat.-Nr.S7048
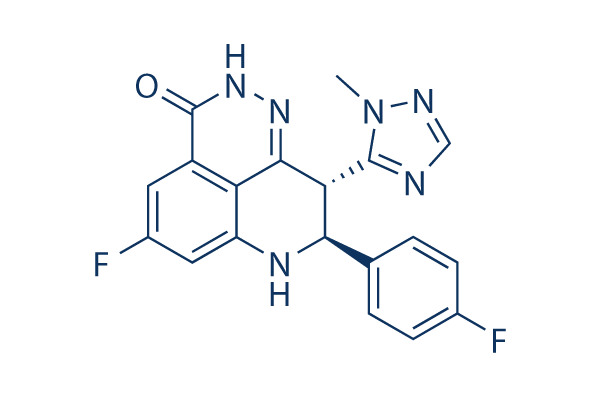
Chemische Struktur
Molekulargewicht: 380.35
Qualitätskontrolle
| Verwandte Ziele | HDAC ATM/ATR DNA-PK WRN DNA/RNA Synthesis Topoisomerase PPAR Sirtuin Casein Kinase eIF |
|---|---|
| Weitere PARP Inhibitoren | XAV-939 AZD5305 (Saruparib) Veliparib (ABT-888) PJ34 HCl AG-14361 Iniparib (BSI-201) G007-LK Pamiparib UPF 1069 A-966492 |
Zellkultur, Behandlung & Arbeitskonzentration
| Zelllinien | Assay-Typ | Konzentration | Inkubationszeit | Formulierung | Aktivitätsbeschreibung | PMID |
|---|---|---|---|---|---|---|
| BR5FVB1-Akt | Growth Inhibition Assay | 0.1-100 nM | 24/48/72 h | inhibits cell proliferation dose dependently | 26047697 | |
| BR5FVB1-Akt | Apoptosis Assay | 0.1-100 nM | 72 h | induces apoptosis | 26047697 | |
| Capan-1 | Growth Inhibition Assay | IC50=16.0 ± 5.4 µM | 25864590 | |||
| MIA PaCa-2 | Growth Inhibition Assay | IC50=58.23 ± 8.1 µM | 25864590 | |||
| RD | Growth Inhibition Assay | IC50=8.7 nM | 25263539 | |||
| Rh41 | Growth Inhibition Assay | IC50=8.1 nM | 25263539 | |||
| Rh18 | Growth Inhibition Assay | IC50=4.9 nM | 25263539 | |||
| Rh30 | Growth Inhibition Assay | IC50=31.1 nM | 25263539 | |||
| BT-12 | Growth Inhibition Assay | IC50> 1,000 nM | 25263539 | |||
| CHLA-266 | Growth Inhibition Assay | IC50> 1,000 nM | 25263539 | |||
| TC-71 | Growth Inhibition Assay | IC50=3.7 nM | 25263539 | |||
| CHLA-9 | Growth Inhibition Assay | IC50=8.2 nM | 25263539 | |||
| CHLA-10 | Growth Inhibition Assay | IC50=67.8 nM | 25263539 | |||
| CHLA-258 | Growth Inhibition Assay | IC50=4.6 nM | 25263539 | |||
| SJ-GBM2 | Growth Inhibition Assay | IC50=16.2 nM | 25263539 | |||
| NB-1643 | Growth Inhibition Assay | IC50=18.4 nM | 25263539 | |||
| NB-EBc1 | Growth Inhibition Assay | IC50=25.8 nM | 25263539 | |||
| CHLA-90 | Growth Inhibition Assay | IC50> 1,000 nM | 25263539 | |||
| CHLA-136 | Growth Inhibition Assay | IC50=14.2 nM | 25263539 | |||
| NALM-6 | Growth Inhibition Assay | IC50=49 nM | 25263539 | |||
| COG-LL-317 | Growth Inhibition Assay | IC50=9.4 nM | 25263539 | |||
| RS4;11 | Growth Inhibition Assay | IC50=52.6 nM | 25263539 | |||
| MOLT-4 | Growth Inhibition Assay | IC50=16.6 nM | 25263539 | |||
| CCRF-CEM | Growth Inhibition Assay | IC50=697.3 nM | 25263539 | |||
| Kasumi-1 | Growth Inhibition Assay | IC50=786.2 nM | 25263539 | |||
| Karpas-299 | Growth Inhibition Assay | IC50=75.7 nM | 25263539 | |||
| Ramos-RA1 | Growth Inhibition Assay | IC50=68.3 nM | 25263539 | |||
| DT40 | Growth Inhibition Assay | IC50=4 nM | 24356813 | |||
| DU145 | Growth Inhibition Assay | IC50=11 nM | 24356813 | |||
| H209 | Growth Inhibition Assay | IC50=1.7 nM | 24077350 | |||
| H1048 | Growth Inhibition Assay | IC50=2.2 nM | 24077350 | |||
| H524 | Growth Inhibition Assay | IC50=3.1 nM | 24077350 | |||
| H1930 | Growth Inhibition Assay | IC50=4.1 nM | 24077350 | |||
| H69 | Growth Inhibition Assay | IC50=5.2 nM | 24077350 | |||
| H2081 | Growth Inhibition Assay | IC50=6.3 nM | 24077350 | |||
| H2107 | Growth Inhibition Assay | IC50=7.3 nM | 24077350 | |||
| H1092 | Growth Inhibition Assay | IC50=8.9 nM | 24077350 | |||
| DMS-79 | Growth Inhibition Assay | IC50=9.3 nM | 24077350 | |||
| H446 | Growth Inhibition Assay | IC50=13 nM | 24077350 | |||
| COR-L279 | Growth Inhibition Assay | IC50=15 nM | 24077350 | |||
| LoVo | Function assay | 30 mins | EC50 = 0.0025 μM | 25761096 | ||
| MX1 | Cytotoxicity assay | EC50 = 0.0003 μM | 26652717 | |||
| LoVo | Function assay | 30 mins | EC50 = 0.00251 μM | 26652717 | ||
| LoVo | Cytotoxicity assay | 0.4 uM | 5 days | GI50 = 0.004 μM | 26652717 | |
| Capan1 | Cytotoxicity assay | EC50 = 0.005 μM | 26652717 | |||
| MRC5 | Cytotoxicity assay | EC50 = 0.31 μM | 26652717 | |||
| MX1 | Function assay | 1 mg/kg | 2 ,8 and 24 hrs | Decrease in PAR level in athymic nu/nu mouse xenografted with human MX1 cells at 1 mg/kg, po administered as single dose measured after 2 ,8 and 24 hrs by ELISA | 26652717 | |
| MX1 | Antitumor assay | 0.33 mg/kg | 28 days | Antitumor activity against BRCA1 deficient human MX1 cells xenografted in athymic nu/nu mouse at 0.33 mg/kg, po qd administered for 28 days | 26652717 | |
| MX1 | Antitumor assay | 0.165 mg/kg | 28 days | Antitumor activity against BRCA1 deficient human MX1 cells xenografted in athymic nu/nu mouse assessed as tumor growth inhibition at 0.165 mg/kg, po administered twice a day for 28 days | 26652717 | |
| MX1 | Function assay | 0.33 mg/kg | Potentiation of carboplatin-induced tumor growth inhibition of BRCA1 deficient human MX1 cells xenografted in athymic nu/nu mouse at 0.33 mg/kg po and animals were treated with carboplatin at 35 mg/kg, ip on day 1 | 26652717 | ||
| MDA-MB-436 | Antiproliferative assay | 7 days | IC50 = 0.0007 μM | 28692916 | ||
| Capan1 | Antiproliferative assay | 7 days | IC50 = 0.0018 μM | 28692916 | ||
| VC8 | Cytotoxicity assay | 3 days | IC50 = 0.0042 μM | 28692916 | ||
| V79 | Cytotoxicity assay | 3 days | IC50 = 5.0114 μM | 28692916 | ||
| Capan1 | Function assay | 0.1 uM | 4 hrs | Inhibition of PARP1 in BRCA2 deficient human Capan1 cells assessed as increase in PARP1-DNA trapping at 0.1 uM after 4 hrs by Western blot analysis | 28692916 | |
| MDA-MB-436 | Function assay | 1 uM | 4 hrs | Inhibition of PARP1 in BRCA1 deficient human MDA-MB-436 cells assessed as increase in PARP1-DNA trapping at 1 uM after 4 hrs by Western blot analysis | 28692916 | |
| Klicken Sie hier, um weitere experimentelle Daten zu Zelllinien anzuzeigen | ||||||
Chemische Informationen, Lagerung & Stabilität
| Molekulargewicht | 380.35 | Formel |
C19H14F2N6O
|
Lagerung (Ab dem Eingangsdatum) | |
|---|---|---|---|---|---|
| CAS-Nr. | 1207456-01-6 | -- | Lagerung von Stammlösungen |
|
|
| Synonyme | LT-673 | Smiles | CN1C(=NC=N1)C2C(NC3=CC(=CC4=C3C2=NNC4=O)F)C5=CC=C(C=C5)F | ||
Löslichkeit
|
In vitro |
DMSO
: 19 mg/mL
(49.95 mM)
Water : Insoluble Ethanol : Insoluble |
Molaritätsrechner
|
In vivo |
|||||
In-vivo-Formulierungsrechner (Klare Lösung)
Schritt 1: Geben Sie die untenstehenden Informationen ein (Empfohlen: Ein zusätzliches Tier zur Berücksichtigung von Verlusten während des Experiments)
Schritt 2: Geben Sie die In-vivo-Formulierung ein (Dies ist nur der Rechner, keine Formulierung. Bitte kontaktieren Sie uns zuerst, wenn es im Abschnitt "Löslichkeit" keine In-vivo-Formulierung gibt.)
Berechnungsergebnisse:
Arbeitskonzentration: mg/ml;
Methode zur Herstellung der DMSO-Stammlösung: mg Wirkstoff vorgelöst in μL DMSO ( Konzentration der Stammlösung mg/mL, Bitte kontaktieren Sie uns zuerst, wenn die Konzentration die DMSO-Löslichkeit der Wirkstoffcharge überschreitet. )
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügenμL PEG300, mischen und klären, dann hinzufügenμL Tween 80, mischen und klären, dann hinzufügen μL ddH2O, mischen und klären.
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügen μL Maisöl, mischen und klären.
Hinweis: 1. Bitte stellen Sie sicher, dass die Flüssigkeit klar ist, bevor Sie das nächste Lösungsmittel hinzufügen.
2. Achten Sie darauf, das/die Lösungsmittel der Reihe nach hinzuzufügen. Sie müssen sicherstellen, dass die bei der vorherigen Zugabe erhaltene Lösung eine klare Lösung ist, bevor Sie mit der Zugabe des nächsten Lösungsmittels fortfahren. Physikalische Methoden wie Vortex, Ultraschall oder ein heißes Wasserbad können zur Unterstützung des Lösens verwendet werden.
Wirkmechanismus
| Merkmale |
Most potent and selective PARPi reported thus far.
|
|---|---|
| Targets/IC50/Ki |
PARP1
(Cell-free assay) 0.57 nM
|
| In vitro |
BMN-673 bindet selektiv an PARP und verhindert die PARP-vermittelte DNA-Reparatur von Einzelstrang-DNA-Brüchen über den Basenexzisionsreparaturweg. Dies verstärkt die Akkumulation von DNA-Strangbrüchen, fördert genomische Instabilität und führt schließlich zur Apoptose. BMN 673 tötet selektiv Krebszellen mit BRCA-1- oder BRCA-2-Mutationen ab. BMN 673 zeigt eine Einzelwirkstoff-Zytotoxizität in BRCA-1-mutierten (MX-1, IC50 = 0,3 nM) und BRCA-2-mutierten Zellen (Capan-1, IC50 = 5 nM). Im Gegensatz dazu liegt die IC50 von BMN 673 in MRC-5 normalen menschlichen Fibroblasten und anderen Tumorzelllinien mit Wildtyp-BRCA-1- und BRCA-2-Genen zwischen 90 nM und 1,9 μM. Off-Target-Molekül-Screening identifizierte keine signifikante unspezifische Aktivität für diese Klasse von PARP-Inhibitoren. |
| In vivo |
In pharmakokinetischen Studien an Ratten zeigt BMN 673 eine orale Bioverfügbarkeit von >50 % und pharmakokinetische Eigenschaften, die eine einmal tägliche Dosierung ermöglichen. In Studien am MX-1-Xenograft-Tumormodell verstärkt die tägliche orale Verabreichung von BMN 673 die Antitumorwirkungen zytotoxischer Therapien dosisabhängig signifikant. |
Literatur |
|
Anwendungen
| Methoden | Biomarker | Bilder | PMID |
|---|---|---|---|
| Western blot | pKAP1 / pChk2 / pChk1 cleaved-PARP / cleaved-caspase3 / γ-H2AX p-ATM PD-L1 |
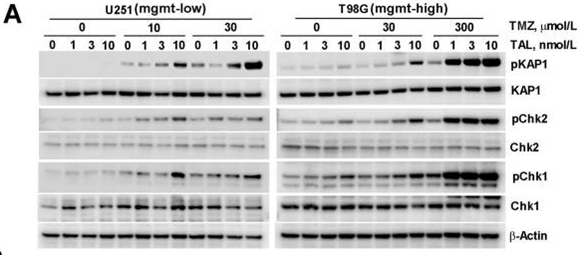
|
28947502 |
| Growth inhibition assay | Cell viability |
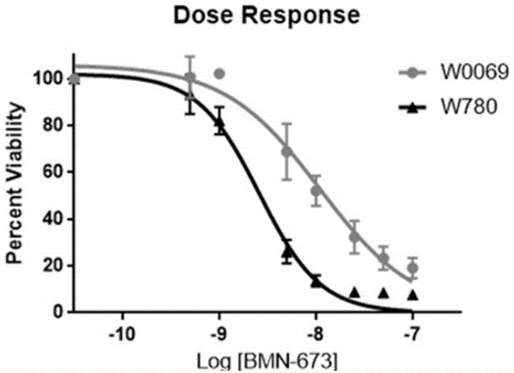
|
29158830 |
| Immunofluorescence | cleaved PARP / 53BP1 RAD51 |
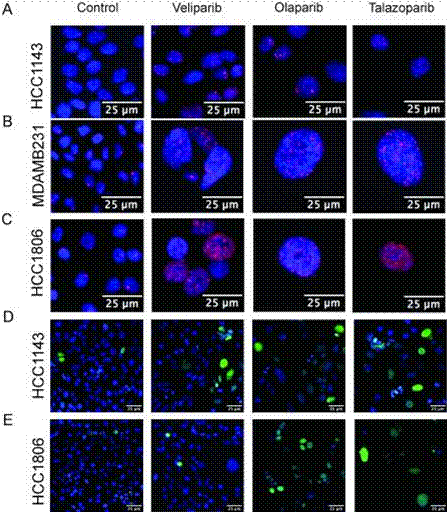
|
28958991 |
Klinische Studieninformationen
(Daten von https://clinicaltrials.gov, aktualisiert am 2024-05-22)
| NCT-Nummer | Rekrutierung | Erkrankungen | Sponsor/Kooperationspartner | Startdatum | Phasen |
|---|---|---|---|---|---|
| NCT05425862 | Suspended | Metastatic Castration Resistant Prostate Cancer (mCRPC) |
Peter MacCallum Cancer Centre Australia |
October 21 2022 | Phase 1 |
| NCT05141708 | Completed | Metastatic Breast Cancer|Breast Neoplasms |
Pfizer |
December 17 2021 | -- |
| NCT05053854 | Recruiting | Neuroendocrine Tumors |
Peter MacCallum Cancer Centre Australia |
December 8 2021 | Phase 1 |
| NCT04991480 | Active not recruiting | Advanced Cancer|Metastatic Cancer|Breast Cancer |
Artios Pharma Ltd |
September 13 2021 | Phase 1|Phase 2 |
| NCT04987931 | Completed | Breast Cancer |
Pfizer |
August 20 2021 | -- |
Technischer Support
Tel: +1-832-582-8158 Ext:3
Wenn Sie weitere Fragen haben, hinterlassen Sie bitte eine Nachricht.
Häufig gestellte Fragen
Frage 1:
Which solvent do you recommend to dilute it for in vivo study in mice?
Antwort:
According to the paper: http://clincancerres.aacrjournals.org/content/19/18/5003.full, it can be dissolved in vehicle (10% DMAc, 6% Solutol, and 84% PBS). Quote from Method and Material section "Xenograft experiments: BMN 673 (various doses as indicated), or vehicle (10% DMAc, 6% Solutol, and 84% PBS) was administered by oral gavage"
