nur für Forschungszwecke
URB597 FAAH Inhibitor
Kat.-Nr.S2631
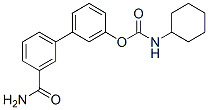
Chemische Struktur
Molekulargewicht: 338.4
Qualitätskontrolle
- In Nature Medicine für seine erstklassige Qualität zitiert
- COA
- NMR
- HPLC
- SDS
- Datenblatt
| Verwandte Ziele | Dehydrogenase HSP Transferase P450 (e.g. CYP17) PDE phosphatase PPAR Vitamin Carbohydrate Metabolism Mitochondrial Metabolism |
|---|---|
| Weitere FAAH Inhibitoren | Biochanin A PF-3845 PF-04457845 JNJ-42165279 JNJ-1661010 LY-2183240 FAAH-IN-2 BIA 10-2474 JZL195 URB937 |
Chemische Informationen, Lagerung & Stabilität
| Molekulargewicht | 338.4 | Formel | C20H22N2O3 |
Lagerung (Ab dem Eingangsdatum) | |
|---|---|---|---|---|---|
| CAS-Nr. | 546141-08-6 | SDF herunterladen | Lagerung von Stammlösungen |
|
|
| Synonyme | KDS-4103 | Smiles | C1CCC(CC1)NC(=O)OC2=CC=CC(=C2)C3=CC(=CC=C3)C(=O)N | ||
Löslichkeit
|
In vitro |
DMSO
: 68 mg/mL
(200.94 mM)
Ethanol : 4 mg/mL Water : Insoluble |
Molaritätsrechner
|
In vivo |
|||||
In-vivo-Formulierungsrechner (Klare Lösung)
Schritt 1: Geben Sie die untenstehenden Informationen ein (Empfohlen: Ein zusätzliches Tier zur Berücksichtigung von Verlusten während des Experiments)
Schritt 2: Geben Sie die In-vivo-Formulierung ein (Dies ist nur der Rechner, keine Formulierung. Bitte kontaktieren Sie uns zuerst, wenn es im Abschnitt "Löslichkeit" keine In-vivo-Formulierung gibt.)
Berechnungsergebnisse:
Arbeitskonzentration: mg/ml;
Methode zur Herstellung der DMSO-Stammlösung: mg Wirkstoff vorgelöst in μL DMSO ( Konzentration der Stammlösung mg/mL, Bitte kontaktieren Sie uns zuerst, wenn die Konzentration die DMSO-Löslichkeit der Wirkstoffcharge überschreitet. )
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügenμL PEG300, mischen und klären, dann hinzufügenμL Tween 80, mischen und klären, dann hinzufügen μL ddH2O, mischen und klären.
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügen μL Maisöl, mischen und klären.
Hinweis: 1. Bitte stellen Sie sicher, dass die Flüssigkeit klar ist, bevor Sie das nächste Lösungsmittel hinzufügen.
2. Achten Sie darauf, das/die Lösungsmittel der Reihe nach hinzuzufügen. Sie müssen sicherstellen, dass die bei der vorherigen Zugabe erhaltene Lösung eine klare Lösung ist, bevor Sie mit der Zugabe des nächsten Lösungsmittels fortfahren. Physikalische Methoden wie Vortex, Ultraschall oder ein heißes Wasserbad können zur Unterstützung des Lösens verwendet werden.
Wirkmechanismus
| Targets/IC50/Ki |
FAAH
4.6 nM
|
|---|---|
| In vitro |
URB597 bindet in der hydrophoben Tasche und im katalytischen Kern von FAAH, der die aktiven Stellenreste mit der Membranoberfläche von FAAH verbindet. Diese Verbindung hemmt die FAAH-Aktivität in humanen Lebermikrosomen mit einer IC50 von 3 nM. Sie reduziert die Expression der LPS-induzierten Enzyme Cyclooxygenase 2 (COX-2) und induzierbare Stickoxid-Synthase (iNOS; NOS2) in primären Ratten-Mikrogliazellen, mit einer gleichzeitigen Reduktion der Freisetzung der entzündungsfördernden Mediatoren Prostaglandin E2 (PGE2) und (NO) Stickoxid. Diese Chemikalie löst Ca2+-Eintritt in HEK293-F-Zellen aus, die transient das menschliche oder Ratten-TRPA1-Gen exprimieren. Sie aktiviert auch den Ca2+-Eintritt in Ratten-DRG-Neuronen, die nativ TRPA1-Kanäle exprimieren.
|
| In vivo |
URB597 hemmt die [3H]Anandamid-Hydrolyse in Rattenhirnmembranen mit einem parallelen Anstieg des Anandamid-, OEA- und PEA-Gehalts im Gehirn durch Hemmung von FAAH. Diese Verbindung verstärkt den durch Ethanolamid induzierten Hypothermie-Effekt durch Hemmung von FAAH. Bei intraperitonealer Verabreichung (0,3 mg/kg) reduziert sie Allodynie und Hyperalgesie durch Cannabinoid CB1- und CB2-Rezeptor-vermittelte Analgesie bei Ratten mit entzündlichen Schmerzen. Diese Chemikalie reduziert die Abnahme der Gewichtszunahme und der Saccharoseaufnahme, die durch chronischen milden Stress bei Ratten induziert wird, durch Hemmung der Gehirn-FAAH-Aktivität. Sie könnte die meisten depressiven Symptome, die durch THC-Exposition im Jugendalter bei weiblichen Ratten hervorgerufen werden, umkehren.
|
Literatur |
|
Technischer Support
Tel: +1-832-582-8158 Ext:3
Wenn Sie weitere Fragen haben, hinterlassen Sie bitte eine Nachricht.
