nur für Forschungszwecke
AG-490 EGFR Inhibitor
Kat.-Nr.S1143
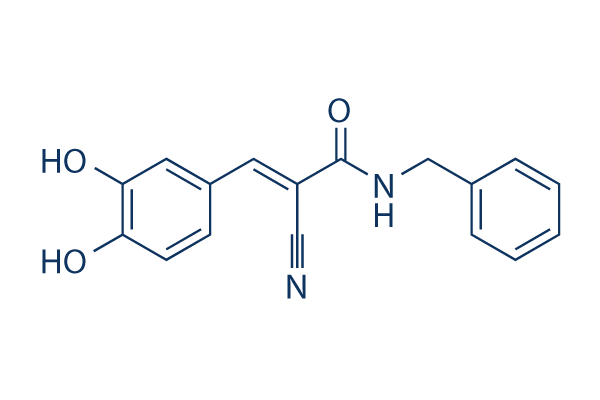
Chemische Struktur
Molekulargewicht: 294.30
Qualitätskontrolle
| Verwandte Ziele | VEGFR PDGFR FGFR c-Met Src MEK CSF-1R FLT3 HER2 c-Kit |
|---|---|
| Weitere EGFR Inhibitoren | Lazertinib (YH25448) Icotinib Hydrochloride Sunvozertinib AG-1478 Canertinib (CI-1033) WZ4002 Rociletinib (CO-1686) Poziotinib (NOV120101, HM781-36B) Genistein Allitinib tosylate |
Zellkultur, Behandlung & Arbeitskonzentration
| Zelllinien | Assay-Typ | Konzentration | Inkubationszeit | Formulierung | Aktivitätsbeschreibung | PMID |
|---|---|---|---|---|---|---|
| BC3 | Function Assay | 100 µM | 24 h | mediates PEL cell apoptosis | ||
| BCBL1 | Function Assay | 100 µM | 24 h | mediates PEL cell apoptosis | ||
| BC3 | Function Assay | 100 µM | 24 h | mediates de-phosphorylation of STAT3 correlated with HSP70 and HSF1 reduction | ||
| BCBL1 | Function Assay | 100 µM | 24 h | mediates de-phosphorylation of STAT3 correlated with HSP70 and HSF2 reduction | ||
| BC3 | Function Assay | 100 µM | 24 h | induces a complete autophagic flux | ||
| BCBL1 | Function Assay | 100 µM | 24 h | induces a complete autophagic flux | ||
| SK-MEL-28 | Function Assay | 50/100 µM | 48 h | DMSO | reduces anoikis resistance | |
| MeWo | Function Assay | 50/100 µM | 48 h | DMSO | reduces anoikis resistance | |
| SK-MEL-5 | Function Assay | 50/100 µM | 48 h | DMSO | reduces anoikis resistance | |
| SK-MEL-2 | Function Assay | 50/100 µM | 48 h | DMSO | reduces anoikis resistance | |
| B16-F0 | Function Assay | 50/100 µM | 48 h | DMSO | reduces anoikis resistance | |
| TRPM2/HEK | Function Assay | 0.1–25 µM | 15 min | DMSO | reduces H2O2-induced Ca2+increase in a concentration-dependent manner, and the IC50 value was 1.7 µM | |
| U937 | Function Assay | 0.1–25 µM | 15 min | DMSO | reduces H2O2-induced Ca2+increase in a concentration-dependent manner, and the IC50 value was 0.4 µM | |
| TRPM2/HEK | Function Assay | 10 µM | 40 min | DMSO | reduces TRPM2 activation even at high concentrations of H2O2 | |
| GL37 | Cell Viability Assay | 0-10 µM | 48 h | suppresses La expression | ||
| NRK-52E | Function Assay | 1 µM | 10 min | blocks the stimulatory effect of Ang II on Pax-2 expression | ||
| NRK-52E | Function Assay | 1 µM | 10 min | blocks Ang II induced CD24 expression | ||
| HSC | Function Assay | 20 μM | 1 h | abrogates the differential effects of leptin or AGEs | ||
| EJ | Growth Inhibition Assay | 50/80 μM | 24/48/72 h | inhibits cell growth in both time and dose dependent manner | ||
| EJ | Growth Inhibition Assay | 50/80 μM | 48 h | causes S-phase arrest | ||
| EJ | Function Assay | 50/80 μM | 48 h | downregulates c-Myc, cyclinD1, survivin and VEGF expressions | ||
| HepG2 | Function Assay | 50-500 μM | 60 min | inhibits the IL-6-induced phosphorylation of STAT1 (Tyr705) and STAT3 (Tyr705) in a dose-dependent manner | ||
| SGC7901 | Cell Viability Assay | 0-100 μM | 24/48/72 h | causes a significant reduction in cell viability dose-dependently but not time-dependently | ||
| AGS | Cell Viability Assay | 0-100 μM | 24/48/72 h | causes a significant reduction in cell viability dose-dependently but not time-dependently | ||
| SGC7901 | Function Assay | 50 μM | 24/48/72 h | the levels of pJAK2 began to decline at 24 hr, and rebounded at 72 hr | ||
| AGS | Function Assay | 50 μM | 24/48/72 h | the levels of pJAK2 began to decline at 24 hr, and rebounded at 72 hr | ||
| SGC7901 | Function Assay | 50 μM | 24/48/72 h | the cytoplasmic localization of pJAK2 (JAK2 phosphorylated at residues Tyr1007 and Tyr1008) decreased after AG490 treatment for 24 and 48 hr, but started to rebound at 72 hr | ||
| AGS | Function Assay | 50 μM | 24/48/72 h | the cytoplasmic localization of pJAK2 (JAK2 phosphorylated at residues Tyr1007 and Tyr1008) decreased after AG490 treatment for 24 and 48 hr, but started to rebound at 72 hr | ||
| MC3T3-E1 | Function Assay | 50 μM | 4 h | inhibits HSE-induced BMP7 and GHR protein expression | ||
| 7TD1-DXM | Growth Inhibition Assay | 10 μM | 72 h | DMSO | inhibits cell growth | |
| 7TD1-WD-90 | Growth Inhibition Assay | 10 μM | 72 h | DMSO | inhibits cell growth | |
| 7TD1-DXM | Apoptosis Assay | 50 μM | 48 h | DMSO | induces apoptosis | |
| 7TD1-WD-90 | Apoptosis Assay | 50 μM | 48 h | DMSO | induces apoptosis | |
| 7TD1-WD-90 | Function Assay | 50 μM | 6 h | DMSO | significantly inhibits the phosphorylation of JAK2 and phosphorylation of STAT3 | |
| HepG2 | Function Assay | 100 μM | 12/24 h | inhibits STAT3 tyrosine phosphorylation | ||
| RAW264.7 | Function Assay | 50 μM | 24/48 h | suppresses RANKL-induced osteoclastogenesis | ||
| RAW264.7 | Growth Inhibition Assay | 0-50 μM | 48 h | inhibits cell growth dose-dependently | ||
| RAW264.7 | Growth Inhibition Assay | 0-50 μM | 48 h | causes an arrest of RAW264.7 cells at the G0/G1 phase of the cell cycle | ||
| RAW264.7 | Function Assay | 50 μM | 24/48 h | inhibits RANKL-induced NFATc1 expression and phosphorylation of Ser727STAT3 | ||
| A549 | Function Assay | 20/40 μM | 20 h | 20 μM AG490 suppresses the radiation-induced invasion of A549 cells | ||
| A549 | Function Assay | 10/20/40 μM | 24 h | suppresses the radiation-induced elevation of VEGF | ||
| HUVECs | Cell Viability Assay | 20 µM | 4 h | attenuates H2O2-induced cell shrinkage and improved the attachment rate of the cells | ||
| HUVECs | Apoptosis Assay | 20 µM | 4 h | significantly decreases the cell apoptotic index | ||
| BV-2 | Function Assay | 20 µM | 16 h | inhibits LPS-induced STAT1 phosphorylation with almost completely diminished iNOS expression | ||
| NRK-52E | Function Assay | 5 μM | 30 min | attenuates Ang-(1–7)-inhibited TGF-β1 mRNA at 16 h | ||
| SW620 | Function Assay | 20 µM | 1/6 h | inhibits p-STAT3 activation | ||
| RPE | Function Assay | 30 µM | 3 h | inhibits the induction of p-STAT3 expression | ||
| SW1116 | Function Assay | 100 µM | 24/48/72 h | decreases the expression of JAK2 and pJAK2 time-dependently | ||
| HT29 | Function Assay | 100 µM | 24/48/72 h | decreases the expression of JAK2 and pJAK2 time-dependently | ||
| SW1116 | Function Assay | 100 µM | 24/48/72 h | decreases the pSTAT3 levels in a time-dependent manner | ||
| HT29 | Function Assay | 100 µM | 24/48/72 h | decreases the pSTAT3 levels in a time-dependent manner | ||
| ARPE-19 | Function Assay | 5 μM | 30 min | inhibits JAK2 phosphorilation | ||
| HSC-T6 | Apoptosis Assay | 10 μM | 2 h | inhibits the apoptosis of HSC-T6 cells induced by CDE | ||
| HSC-T6 | Function Assay | 10 μM | 2 h | inhibits the expressions of pY-STAT1 and Bad induced by CDE | ||
| Hep-2 | Growth Inhibition Assay | 25-100 μM | 24/48/72 h | inhibits cell growth in both time and dose dependent manner | ||
| Hep-2 | Apoptosis Assay | 50 μM | 24/48/72 h | induces cell apoptosis time dependently | ||
| Hep-2 | Function Assay | 50 μM | 24/48/72 h | inhibits G1 to S cell cycle transition and induces G1 cell cycle arrest | ||
| Hep-2 | Function Assay | 50 μM | 24/48/72 h | downregulates the STAT3, p-STAT3 and survivin protein levels | ||
| KF8 | Function Assay | 10 μM | 1 h | DMSO | inhibits IL-33-induced NF-κB activation | |
| KF8 | Function Assay | 10 μM | 1 h | DMSO | inhibits IL-33-induced IκBα degradation and NF-κB activation | |
| HEL | Function Assay | 100 μM | 12-72 h | inhibits the level of p-JAK2, JAK2 | ||
| HEL | Growth Inhibition Assay | 100 μM | 0-5 d | reduces growth of JAK2V617F-expressing HEL cells | ||
| A-172 | Function Assay | 50/100 μM | 48 h | reduces the levels of constitutively activated STAT3 in a time-dependent and dose-dependent fashion | ||
| MZ-18 | Function Assay | 50/100 μM | 48 h | reduces the levels of constitutively activated STAT3 in a time-dependent and dose-dependent fashion | ||
| MZ-54 | Function Assay | 50/100 μM | 48 h | reduces the levels of constitutively activated STAT3 in a time-dependent and dose-dependent fashion | ||
| MZ-256 | Function Assay | 50/100 μM | 48 h | reduces the levels of constitutively activated STAT3 in a time-dependent and dose-dependent fashion | ||
| MZ-304 | Function Assay | 50/100 μM | 48 h | reduces the levels of constitutively activated STAT3 in a time-dependent and dose-dependent fashion | ||
| A-172 | Growth Inhibition Assay | 50/100 μM | 48 h | leads to a statistically significant reduction of cell proliferation over a time period of 48 h | ||
| MZ-18 | Growth Inhibition Assay | 50/100 μM | 48 h | leads to a statistically significant reduction of cell proliferation over a time period of 48 h | ||
| MZ-54 | Growth Inhibition Assay | 50/100 μM | 48 h | leads to a statistically significant reduction of cell proliferation over a time period of 48 h | ||
| MZ-256 | Growth Inhibition Assay | 50/100 μM | 48 h | leads to a statistically significant reduction of cell proliferation over a time period of 48 h | ||
| MZ-304 | Growth Inhibition Assay | 50/100 μM | 48 h | leads to a statistically significant reduction of cell proliferation over a time period of 48 h | ||
| A-172 | Function Assay | 50/100 μM | 48 h | inhibits migration | ||
| MZ-18 | Function Assay | 50/100 μM | 48 h | inhibits migration | ||
| MZ-54 | Function Assay | 50/100 μM | 48 h | inhibits migration | ||
| MZ-256 | Function Assay | 50/100 μM | 48 h | inhibits migration | ||
| MZ-304 | Function Assay | 50/100 μM | 48 h | inhibits migration | ||
| A-172 | Function Assay | 100 μM | 48 h | inhibits invasion | ||
| MZ-18 | Function Assay | 100 μM | 48 h | inhibits invasion | ||
| MZ-54 | Function Assay | 100 μM | 48 h | inhibits invasion | ||
| MZ-256 | Function Assay | 100 μM | 48 h | inhibits invasion | ||
| MZ-304 | Function Assay | 100 μM | 48 h | inhibits invasion | ||
| A-172 | Function Assay | 50/100 μM | 48 h | reduces transcription of MMP genes and reduces enzymatic activity of MMPs | ||
| MZ-18 | Function Assay | 50/100 μM | 48 h | reduces transcription of MMP genes and reduces enzymatic activity of MMPs | ||
| MZ-54 | Function Assay | 50/100 μM | 48 h | reduces transcription of MMP genes and reduces enzymatic activity of MMPs | ||
| MZ-256 | Function Assay | 50/100 μM | 48 h | reduces transcription of MMP genes and reduces enzymatic activity of MMPs | ||
| MZ-304 | Function Assay | 50/100 μM | 48 h | reduces transcription of MMP genes and reduces enzymatic activity of MMPs | ||
| SW1990 | Growth Inhibition Assay | 20 μM | 24/48/72 h | inhibits cell growth time dependently | ||
| SW1990 | Function Assay | 20 μM | 24 h | decreases the expression of MMP-2 and VEGF mRNAs | ||
| SW1990 | Function Assay | 20 μM | 24 h | decreases the intensity of p-Stat3 expression | ||
| SW1990 | Invasion Assay | 20 μM | 24 h | reduces invasion of SW1990 cells | ||
| THP1 | Function Assay | 10 uM | 30 min | inhibits STAT3 tyrosine phosphorylation by over 60% | ||
| BMMC | Function Assay | 0-10 μM | 15 min | inhibits LTC4 release in a dose-dependent fashion with near complete inhibition at concentrations ⩾10 μM | ||
| A549 | Function Assay | 15 μm | 1 h | inhibits the phosphorylation of STAT1 on tyrosine 701 was detected 15 min after SPE B treatment | ||
| OVCAR-3 | Function Assay | 10 uM | 1 h | inhibits LPA-induced STAT3 phosphorylation | ||
| PA-1 | Function Assay | 10 uM | 1 h | inhibits LPA-induced STAT3 phosphorylation | ||
| OVCAR-3 | Function Assay | 10 uM | 1 h | inhibits LPA-induced ovarian cancer cell motility | ||
| PA-1 | Function Assay | 10 uM | 1 h | inhibits LPA-induced ovarian cancer cell motility | ||
| Jurkat | Growth Inhibition Assay | 50 μM | 24/48/72 h | enhances TRAIL-induces cell growth inhibition | ||
| SUPT1 | Growth Inhibition Assay | 50 μM | 24/48/72 h | enhances TRAIL-induces cell growth inhibition | ||
| Jurkat | Apoptosis Assay | 50 μM | 24/48 h | enhances TRAIL-induces cell apoptosis | ||
| SUPT1 | Apoptosis Assay | 50 μM | 24/48 h | enhances TRAIL-induces cell apoptosis | ||
| Klicken Sie hier, um weitere experimentelle Daten zu Zelllinien anzuzeigen | ||||||
Chemische Informationen, Lagerung & Stabilität
| Molekulargewicht | 294.30 | Formel | C17H14N2O3 |
Lagerung (Ab dem Eingangsdatum) | |
|---|---|---|---|---|---|
| CAS-Nr. | 133550-30-8 | SDF herunterladen | Lagerung von Stammlösungen |
|
|
| Synonyme | Tyrphostin B42, Zinc02557947 | Smiles | C1=CC=C(C=C1)CNC(=O)C(=CC2=CC(=C(C=C2)O)O)C#N | ||
Löslichkeit
|
In vitro |
DMSO
: 58 mg/mL
(197.07 mM)
Ethanol : 9 mg/mL Water : Insoluble |
Molaritätsrechner
|
In vivo |
|||||
In-vivo-Formulierungsrechner (Klare Lösung)
Schritt 1: Geben Sie die untenstehenden Informationen ein (Empfohlen: Ein zusätzliches Tier zur Berücksichtigung von Verlusten während des Experiments)
Schritt 2: Geben Sie die In-vivo-Formulierung ein (Dies ist nur der Rechner, keine Formulierung. Bitte kontaktieren Sie uns zuerst, wenn es im Abschnitt "Löslichkeit" keine In-vivo-Formulierung gibt.)
Berechnungsergebnisse:
Arbeitskonzentration: mg/ml;
Methode zur Herstellung der DMSO-Stammlösung: mg Wirkstoff vorgelöst in μL DMSO ( Konzentration der Stammlösung mg/mL, Bitte kontaktieren Sie uns zuerst, wenn die Konzentration die DMSO-Löslichkeit der Wirkstoffcharge überschreitet. )
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügenμL PEG300, mischen und klären, dann hinzufügenμL Tween 80, mischen und klären, dann hinzufügen μL ddH2O, mischen und klären.
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügen μL Maisöl, mischen und klären.
Hinweis: 1. Bitte stellen Sie sicher, dass die Flüssigkeit klar ist, bevor Sie das nächste Lösungsmittel hinzufügen.
2. Achten Sie darauf, das/die Lösungsmittel der Reihe nach hinzuzufügen. Sie müssen sicherstellen, dass die bei der vorherigen Zugabe erhaltene Lösung eine klare Lösung ist, bevor Sie mit der Zugabe des nächsten Lösungsmittels fortfahren. Physikalische Methoden wie Vortex, Ultraschall oder ein heißes Wasserbad können zur Unterstützung des Lösens verwendet werden.
Wirkmechanismus
| Targets/IC50/Ki |
JAK2 (V617F)
EGFR
(Cell-free assay) 0.1 μM
|
|---|---|
| In vitro |
AG-490 hemmt die HER-2-getriebene Zellproliferation mit einer IC50 von 3,5 μM. Entsprechend der spezifischen dosisabhängigen Hemmung von konstitutiv aktiviertem JAK2 in Vorläufer-B-akuten Leukämiezellen (ALL) blockiert diese Verbindung (5 μM) das Wachstum aller ALL-Zellen fast vollständig durch Induktion des programmierten Zelltods, ohne schädliche Auswirkungen auf die normale Hämatopoese. Diese Chemikalie hemmt die Aktivitäten von Lck, Lyn, Btk, Syk und Src nicht. Sie (60-100 μM) blockiert die konstitutive Aktivierung von Stat3sm und hemmt das spontane sowie Interleukin-2-induzierte Wachstum von Mycosis fungoides (MF) Tumorzellen mit IC50-Werten von 75 μM bzw. 20 μM. Diese Verbindung hemmt potent das IL-2-vermittelte Wachstum menschlicher T-Zellen mit einer IC50 von 25 μM, indem sie die Aktivitäten von JAK3 und STAT5a/b blockiert. Sie hemmt signifikant die konstitutive Aktivierung von Stat3 in MOPC-, MPC11- und S194-Zellen, was zu einer dramatischen dosisabhängigen Apoptose führt. Diese Chemikalie (100 μM) hemmt die Akt-Phosphorylierung, hemmt die Aktivierung des nukleären Faktors κB und verursacht die Aktivierung von GSK-3β, was zur Reduktion von c-Myc führt. Sie (50 μM) kann die Apoptose von BaF3-Zellen induzieren, die T315I- und E255K-Mutanten von Bcr-Abl exprimieren. Diese Verbindung bei 30 μM hemmt nicht nur die Epo-induzierte Phosphorylierung von Wildtyp-JAK2, sondern auch die konstitutive Phosphorylierung des JAK2 V617F-Mutanten. Sie hemmt auch potent das Zytokin-unabhängige Zellwachstum, das durch den JAK2 V617F-Mutanten in BaF3-Zellen induziert wird. |
| Kinase-Assay |
In-vitro-Kinase-Autophosphorylierung
|
|
AG-490 wird in DMSO 10%-H2O-Ethanol 45% gelöst. Rohe Membranextrakte (0,125 μg/mL) werden mit EGF (20 nM) in 50 mM HEPES-Puffer, pH 7,6, und 125 mM NaCl, 15 Minuten bei 4 °C voraktiviert. Die Autophosphorylierungsaktivität der EGFR- oder ErbB2-Kinase wird bei 4 °C für 30 Sekunden in V-förmigen 96-Well-Platten getestet. Membranextrakte (8 μL) werden zu jeder Vertiefung mit Reaktionsgemisch (12 μL, 50mM, HEPES, pH 7,4, 125 mM NaCl, 12 mM M8Ac2, 2 mM MnCl2, 1 mM NaVO3, 1 μM ATP und 1 μCi[γ-32P]ATP, Endkonzentrationen) und zunehmenden Konzentrationen dieser Verbindung (4 μL) gegeben. Nach Beendigung durch Zugabe von heißem Probenpuffer werden die Proben auf einer 6%igen SDS-Polyacrylamidgel-Elektrophorese-Minigel aufgetragen, die Gele getrocknet und eine Autoradiographie während der linearen Expositionszeit durchgeführt. Die Rezeptorbanden werden densitometrisch gescannt und die Ergebnisse mit dem Ez-Fit-Programm analysiert. Zur Analyse der Autophosphorylierung von JAK2 wird JAK2 mittels Anti-JAK2-Antikörper aus Lysaten von G2-Zellen immunpräzipitiert, die 16 Stunden lang mit zunehmenden Konzentrationen dieser Chemikalie (0-50 μM) vorbehandelt wurden. Immunkomplexe werden dann mit Anti-Phosphotyrosin-Antikörpern immungeblottet. Eine dosisabhängige Hemmung der In-vitro-Kinaseaktivität wird durch Bewertung der JAK2-Autophosphorylierung nachgewiesen.
|
|
| In vivo |
Die Verabreichung von AG-490 reduziert drastisch die Anzahl der CD45+- und HLA-DR+-Zellen von 48 % und 46 % im Knochenmark unbehandelter Mäuse sowie 38 % und 22 % in der Milz unbehandelter Mäuse auf nicht nachweisbare Werte. Die In-vivo-Verabreichung dieser Verbindung führt zur Apoptose muriner Myelom-Tumorzellen, hemmt jedoch nicht die IL-12-vermittelte Makrophagenaktivierung und IFN-γ-Produktion durch Lymphozyten. In Übereinstimmung mit der In-vitro-Blockierung der JAK2 V617F-Mutantenaktivität hemmt die Behandlung mit dieser Chemikalie bei 0,5 mg/Tag über 10 Tage die JAK2 V617F-Mutanten-induzierte Tumorentstehung und Tumorzellinvasion bei Nacktmäusen wirksam. Eine kombinierte Therapie mit diesem Wirkstoff und IL-12 induziert größere Antitumorwirkungen als jeder Wirkstoff allein in einem murinen Myelom-Tumormodell. |
Literatur |
|
Technischer Support
Tel: +1-832-582-8158 Ext:3
Wenn Sie weitere Fragen haben, hinterlassen Sie bitte eine Nachricht.
Häufig gestellte Fragen
Frage 1:
I would like to know whether it (S1143) goes to CNS through BBB, or not?
Antwort:
It can go through the BBB, as shown in this reference: http://bloodjournal.hematologylibrary.org/content/111/4/2062.full.html.
