nur für Forschungszwecke
AC480 (BMS-599626) HER2 Inhibitor
Kat.-Nr.S1056
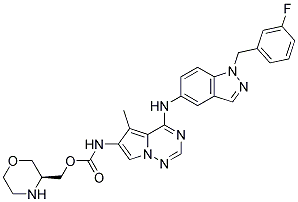
Chemische Struktur
Molekulargewicht: 530.55
Qualitätskontrolle
| Verwandte Ziele | EGFR VEGFR PDGFR FGFR c-Met Src MEK CSF-1R FLT3 c-Kit |
|---|---|
| Weitere HER2 Inhibitoren | CP-724714 Sapitinib (AZD8931) Mubritinib (TAK 165) Tyrphostin AG 879 HER2-Inhibitor-1 TAS0728 Zongertinib |
Chemische Informationen, Lagerung & Stabilität
| Molekulargewicht | 530.55 | Formel | C27H27FN8O3 |
Lagerung (Ab dem Eingangsdatum) | |
|---|---|---|---|---|---|
| CAS-Nr. | 714971-09-2 | SDF herunterladen | Lagerung von Stammlösungen |
|
|
| Synonyme | N/A | Smiles | CC1=C2C(=NC=NN2C=C1NC(=O)OCC3COCCN3)NC4=CC5=C(C=C4)N(N=C5)CC6=CC(=CC=C6)F | ||
Löslichkeit
|
In vitro |
DMSO
: 113 mg/mL
(212.98 mM)
Ethanol : 20 mg/mL Water : Insoluble |
Molaritätsrechner
|
In vivo |
|||||
In-vivo-Formulierungsrechner (Klare Lösung)
Schritt 1: Geben Sie die untenstehenden Informationen ein (Empfohlen: Ein zusätzliches Tier zur Berücksichtigung von Verlusten während des Experiments)
Schritt 2: Geben Sie die In-vivo-Formulierung ein (Dies ist nur der Rechner, keine Formulierung. Bitte kontaktieren Sie uns zuerst, wenn es im Abschnitt "Löslichkeit" keine In-vivo-Formulierung gibt.)
Berechnungsergebnisse:
Arbeitskonzentration: mg/ml;
Methode zur Herstellung der DMSO-Stammlösung: mg Wirkstoff vorgelöst in μL DMSO ( Konzentration der Stammlösung mg/mL, Bitte kontaktieren Sie uns zuerst, wenn die Konzentration die DMSO-Löslichkeit der Wirkstoffcharge überschreitet. )
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügenμL PEG300, mischen und klären, dann hinzufügenμL Tween 80, mischen und klären, dann hinzufügen μL ddH2O, mischen und klären.
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügen μL Maisöl, mischen und klären.
Hinweis: 1. Bitte stellen Sie sicher, dass die Flüssigkeit klar ist, bevor Sie das nächste Lösungsmittel hinzufügen.
2. Achten Sie darauf, das/die Lösungsmittel der Reihe nach hinzuzufügen. Sie müssen sicherstellen, dass die bei der vorherigen Zugabe erhaltene Lösung eine klare Lösung ist, bevor Sie mit der Zugabe des nächsten Lösungsmittels fortfahren. Physikalische Methoden wie Vortex, Ultraschall oder ein heißes Wasserbad können zur Unterstützung des Lösens verwendet werden.
Wirkmechanismus
| Targets/IC50/Ki |
HER1
20 nM
HER2
30 nM
HER4
190 nM
|
|---|---|
| In vitro |
AC480 (BMS-599626) wird als ATP-kompetitiver Inhibitor für HER1 und als ATP-nicht-kompetitiver Inhibitor für HER2 mit Ki von 2 nM bzw. 5 nM identifiziert. Es hemmt auch den verwandten Rezeptor HER4, jedoch mit reduzierter Potenz mit einem IC50 von 190 nM. Diese Verbindung hemmt die Proliferation von Tumorzellen, die hohe Mengen an HER1 und/oder HER2 exprimieren, einschließlich Sal2-, BT474-, N87-, KPL-4-, HCC202-, HCC1954-, HCC1419-, AU565-, ZR-75-30-, MDA-MB-175-, GEO- und PC9-Zellen mit IC50 von 0,24 μM, 0,31 μM, 0,45 μM, 0,38 μM, 0,94 μM, 0,34 μM, 0,75 μM, 0,63 μM, 0,51 μM, 0,84 μM, 0,90 μM bzw. 0,34 μM. Während die Proliferation der Ovarialtumorzelllinie A2780 und von MRC5-Fibroblasten, die weder HER1 noch HER2 exprimieren, nicht signifikant gehemmt wird. Eine aktuelle Studie zeigt, dass es die Radioempfindlichkeit von HN-5-Zellen, die sowohl EGFR als auch Her2 exprimieren, signifikant erhöht, indem es die Zyklusumverteilung fördert und die DNA-Reparatur hemmt.
|
| Kinase-Assay |
Protein kinase assays
|
|
Die gesamten zytoplasmatischen Sequenzen von HER1, HER2 und HER4 werden als rekombinante Proteine in Sf9-Insektenzellen exprimiert. HER1 und HER4 werden als Fusionsproteine mit Glutathion-S-Transferase exprimiert und durch Affinitätschromatographie an Glutathion-S-Sepharose gereinigt. HER2 wird in den pBlueBac4-Vektor subkloniert und als unmarkiertes Protein unter Verwendung eines internen Methionincodons (M687) für die Translationsinitiierung exprimiert. Das verkürzte HER2-Protein wird durch Chromatographie an einer DEAE-Sepharose-Säule isoliert, die in einem Puffer mit 0,1 M NaCl äquilibriert ist, und das rekombinante Protein wird mit einem Puffer mit 0,3 M NaCl eluiert. Für die HER-Kinase-Assays betragen die Reaktionsvolumina 50 μL und enthalten 10 ng Glutathion-S-Transferase-Fusionsprotein oder 150 ng partiell gereinigtes HER2. Die Mischungen enthalten auch 1,5 μM Poly(Glu/Tyr) (4:1), 1 μM ATP, 0,15 μCi [γ-33P]ATP, 50 mM Tris-HCl (pH 7,7), 2 mM DTT, 0,1 mg/mL Rinderserumalbumin und 10 mM MnCl2. Die Reaktionen werden 1 Stunde lang bei 27 °C durchgeführt und durch Zugabe von 10 μL eines Stopppuffers (2,5 mg/mL Rinderserumalbumin und 0,3 M EDTA), gefolgt von einer 108-μL-Mischung aus 3,5 mM ATP und 5 % Trichloressigsäure, beendet. Säureunlösliche Proteine werden auf GF/C-Unifilterplatten mit einem Filtermate-Harvester gewonnen. Der Einbau von radioaktivem Phosphat in das Poly(Glu/Tyr)-Substrat wird durch Flüssigszintillationszählung bestimmt. Die prozentuale Hemmung der Kinaseaktivität wird durch nichtlineare Regressionsanalysen bestimmt, und die Daten werden als die inhibitorische Konzentration angegeben, die zur Erzielung einer 50 %igen Hemmung im Vergleich zu Kontrollreaktionen erforderlich ist (IC50). Die Daten sind die Durchschnitte von Dreifachbestimmungen. Alle anderen Protein Tyrosine Kinase werden ebenfalls unter Verwendung von Poly(Glu/Tyr) als Substrat getestet. Die Kinetik der HER1- und HER2-Hemmung wird in Reaktionsmischungen bestimmt, die unterschiedliche Konzentrationen von ATP und AC480 (BMS-599626) enthalten.
|
|
| In vivo |
AC480 (BMS-599626) zeigt eine potente Antitumoraktivität in einem menschlichen Brusttumor-KPL-4-Xenograft bei seiner maximal verträglichen Dosis von 180 mg/kg und hat auch eine ähnliche Antitumoraktivität in anderen HER2-amplifizierten Xenograft-Modellen sowie anderen HER1-überexprimierenden Xenograft-Modellen. In vivo führt die orale Verabreichung dieser Verbindung zu einer dosisabhängigen Hemmung des Sal2-Tumorwachstums bei Dosen von 60 mg/kg bis 240 mg/kg.
|
Literatur |
|
Klinische Studieninformationen
(Daten von https://clinicaltrials.gov, aktualisiert am 2024-05-22)
| NCT-Nummer | Rekrutierung | Erkrankungen | Sponsor/Kooperationspartner | Startdatum | Phasen |
|---|---|---|---|---|---|
| NCT01245543 | Withdrawn | Solid Tumors |
Daiichi Sankyo |
November 2010 | Phase 1 |
| NCT00979173 | Completed | Glioma |
Annick Desjardins|Ambit Biosciences Corporation|Duke University |
November 2009 | Phase 1 |
| NCT00093730 | Completed | Unspecified Adult Solid Tumor Protocol Specific |
Jonsson Comprehensive Cancer Center|National Cancer Institute (NCI) |
August 2004 | Phase 1 |
| NCT00095537 | Completed | Cancer|Metastases |
Bristol-Myers Squibb |
March 2004 | Phase 1 |
Technischer Support
Tel: +1-832-582-8158 Ext:3
Wenn Sie weitere Fragen haben, hinterlassen Sie bitte eine Nachricht.
