nur für Forschungszwecke
Bupivacaine HCl Sodium Channel Inhibitor
Kat.-Nr.S2454
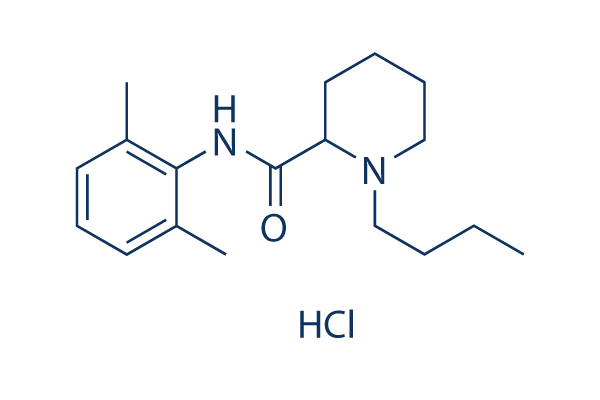
Chemische Struktur
Molekulargewicht: 324.89
Qualitätskontrolle
| Verwandte Ziele | CFTR CRM1 CD markers AChR Calcium Channel Potassium Channel GABA Receptor TRP Channel ATPase GluR |
|---|---|
| Weitere Sodium Channel Inhibitoren | Camostat Mesilate A-803467 cariporide Tolperisone HCl Vinpocetine Veratramine Bulleyaconi cine A Ambroxol HCl Benzocaine Nefopam HCl |
Chemische Informationen, Lagerung & Stabilität
| Molekulargewicht | 324.89 | Formel | C18H28N2O.HCl |
Lagerung (Ab dem Eingangsdatum) | |
|---|---|---|---|---|---|
| CAS-Nr. | 18010-40-7 | SDF herunterladen | Lagerung von Stammlösungen |
|
|
| Synonyme | N/A | Smiles | CCCCN1CCCCC1C(=O)NC2=C(C=CC=C2C)C.Cl | ||
Löslichkeit
|
In vitro |
DMSO
: 65 mg/mL
(200.06 mM)
Water : 65 mg/mL Ethanol : 65 mg/mL |
Molaritätsrechner
|
In vivo |
|||||
In-vivo-Formulierungsrechner (Klare Lösung)
Schritt 1: Geben Sie die untenstehenden Informationen ein (Empfohlen: Ein zusätzliches Tier zur Berücksichtigung von Verlusten während des Experiments)
Schritt 2: Geben Sie die In-vivo-Formulierung ein (Dies ist nur der Rechner, keine Formulierung. Bitte kontaktieren Sie uns zuerst, wenn es im Abschnitt "Löslichkeit" keine In-vivo-Formulierung gibt.)
Berechnungsergebnisse:
Arbeitskonzentration: mg/ml;
Methode zur Herstellung der DMSO-Stammlösung: mg Wirkstoff vorgelöst in μL DMSO ( Konzentration der Stammlösung mg/mL, Bitte kontaktieren Sie uns zuerst, wenn die Konzentration die DMSO-Löslichkeit der Wirkstoffcharge überschreitet. )
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügenμL PEG300, mischen und klären, dann hinzufügenμL Tween 80, mischen und klären, dann hinzufügen μL ddH2O, mischen und klären.
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügen μL Maisöl, mischen und klären.
Hinweis: 1. Bitte stellen Sie sicher, dass die Flüssigkeit klar ist, bevor Sie das nächste Lösungsmittel hinzufügen.
2. Achten Sie darauf, das/die Lösungsmittel der Reihe nach hinzuzufügen. Sie müssen sicherstellen, dass die bei der vorherigen Zugabe erhaltene Lösung eine klare Lösung ist, bevor Sie mit der Zugabe des nächsten Lösungsmittels fortfahren. Physikalische Methoden wie Vortex, Ultraschall oder ein heißes Wasserbad können zur Unterstützung des Lösens verwendet werden.
Wirkmechanismus
| Targets/IC50/Ki |
Sodium channel
|
|---|---|
| In vitro |
Bupivacaine-Lösung ist in vitro nach nur 15 bis 30 Minuten Einwirkzeit zytotoxisch für bovine Gelenkchondrozyten und Gelenkknorpel. Bupivacaine wirkt in isolierten Mitochondrien als Entkoppler zwischen Sauerstoffverbrauch und Phosphorylierung von Adenosindiphosphat. Bupivacaine verursacht eine konzentrationsabhängige mitochondriale Depolarisation und Pyridinnukleotidoxidation in isolierten Mitochondrien, die mit einem erhöhten Sauerstoffverbrauch bei Bupivacaine-Konzentrationen von 1,5 mM oder weniger bei pH 7,4 einhergehen, während die Atmung bei höheren Konzentrationen gehemmt wird. Bupivacaine verursacht die Öffnung des Permeabilitätstransitionskanals (PTP), eines Cyclosporin A-sensitiven inneren Membrankanals, der eine Schlüsselrolle bei vielen Formen des Zelltods spielt. Bupivacaine verursacht mitochondriale Depolarisation und Pyridinnukleotidoxidation, die mit erhöhten Konzentrationen von zytosolischem freiem Ca(2+), der Freisetzung von Cytochrom c und schließlich einer Hyperkontraktur in intakten Flexor digitorum brevis-Fasern einhergehen. Bupivacaine hemmt GIRK-Kanäle innerhalb von Sekunden nach der Anwendung, unabhängig davon, ob die Kanäle über den muskarinischen Rezeptor oder direkt über coexprimierte G-Protein-G(beta)gamma-Untereinheiten aktiviert werden. Bupivacaine hemmt auch alkoholinduzierte GIRK-Ströme in Abwesenheit funktionsfähiger Pertussis-Toxin-sensitiver G-Proteine. Bupivacaine HCl hemmt auch potent die cAMP-Produktion mit einem IC50 von 2,3 μM.
|
| In vivo |
Bupivacaine induziert bei Ratten nicht nur die Ca2+-Freisetzung aus dem sarkoplasmatischen Retikulum (SR), sondern hemmt auch die Ca2+-Aufnahme durch das SR, die hauptsächlich durch die SR Ca2+-Adenosintriphosphatase-Aktivität reguliert wird.
|
Literatur |
|
Klinische Studieninformationen
(Daten von https://clinicaltrials.gov, aktualisiert am 2024-05-22)
| NCT-Nummer | Rekrutierung | Erkrankungen | Sponsor/Kooperationspartner | Startdatum | Phasen |
|---|---|---|---|---|---|
| NCT05038956 | Not yet recruiting | Video-assisted Thoracic Surgery (VATS) |
University of Utah |
May 1 2024 | -- |
| NCT06252662 | Not yet recruiting | Breast Cancer |
United States Naval Medical Center Portsmouth |
April 2024 | Phase 4 |
| NCT06350981 | Not yet recruiting | Back Pain|Surgery-Complications|Narcotic Use|Physical Stress|Post Operative Pain |
Foundation for Orthopaedic Research and Education|Pacira Pharmaceuticals Inc |
April 1 2024 | Phase 2|Phase 3 |
| NCT04003506 | Not yet recruiting | Pain Postoperative |
The University of Hong Kong |
March 1 2024 | Phase 4 |
| NCT06293404 | Not yet recruiting | Hip Fractures|Spinal Anesthesia |
Ankara City Hospital Bilkent |
March 1 2024 | Not Applicable |
Technischer Support
Tel: +1-832-582-8158 Ext:3
Wenn Sie weitere Fragen haben, hinterlassen Sie bitte eine Nachricht.
