nur für Forschungszwecke
Cyclopamine (11-Deoxojervine) Hedgehog Signaling Pathway Antagonist
Kat.-Nr.S1146
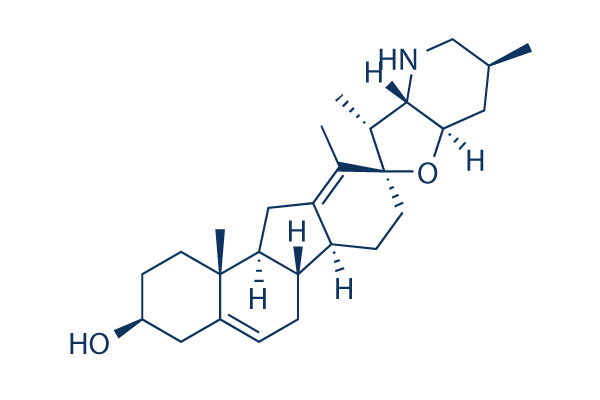
Chemische Struktur
Molekulargewicht: 411.62
Qualitätskontrolle
| Verwandte Ziele | JAK TGF-beta/Smad Wnt/beta-catenin ERK GSK-3 ROCK PKA Secretase STAT Casein Kinase |
|---|---|
| Weitere Hedgehog/Smoothened Inhibitoren | SAG (Smoothened Agonist) Hydrochloride Purmorphamine GANT61 SAG (Smoothened Agonist) SANT-1 HPI-4 (Ciliobrevin A) BMS-833923 Taladegib (LY2940680) Ciliobrevin D PF-5274857 |
Zellkultur, Behandlung & Arbeitskonzentration
| Zelllinien | Assay-Typ | Konzentration | Inkubationszeit | Formulierung | Aktivitätsbeschreibung | PMID |
|---|---|---|---|---|---|---|
| OS-RC-2 | Growth Inhibition Assay | IC50=5.8666 μM | SANGER | |||
| DOHH-2 | Growth Inhibition Assay | IC50=9.35689 μM | SANGER | |||
| no-10 | Growth Inhibition Assay | IC50=9.9039 μM | SANGER | |||
| LS-513 | Growth Inhibition Assay | IC50=11.3547 μM | SANGER | |||
| ALL-PO | Growth Inhibition Assay | IC50=11.7734 μM | SANGER | |||
| 8-MG-BA | Growth Inhibition Assay | IC50=13.1123 μM | SANGER | |||
| RPMI-8402 | Growth Inhibition Assay | IC50=15.8537 μM | SANGER | |||
| EoL-1-cell | Growth Inhibition Assay | IC50=18.5948 μM | SANGER | |||
| NALM-6 | Growth Inhibition Assay | IC50=19.0167 μM | SANGER | |||
| DEL | Growth Inhibition Assay | IC50=20.1471 μM | SANGER | |||
| SR | Growth Inhibition Assay | IC50=23.6715 μM | SANGER | |||
| 697 | Growth Inhibition Assay | IC50=26.6155 μM | SANGER | |||
| COLO-829 | Growth Inhibition Assay | IC50=26.8483 μM | SANGER | |||
| EVSA-T | Growth Inhibition Assay | IC50=27.5561 μM | SANGER | |||
| ATN-1 | Growth Inhibition Assay | IC50=31.2329 μM | SANGER | |||
| L-363 | Growth Inhibition Assay | IC50=31.7461 μM | SANGER | |||
| LAMA-84 | Growth Inhibition Assay | IC50=32.5211 μM | SANGER | |||
| NOS-1 | Growth Inhibition Assay | IC50=34.2956 μM | SANGER | |||
| BB30-HNC | Growth Inhibition Assay | IC50=34.3306 μM | SANGER | |||
| BC-1 | Growth Inhibition Assay | IC50=37.9746 μM | SANGER | |||
| IST-SL2 | Growth Inhibition Assay | IC50=38.224 μM | SANGER | |||
| D-392MG | Growth Inhibition Assay | IC50=40.2215 μM | SANGER | |||
| no-11 | Growth Inhibition Assay | IC50=40.5521 μM | SANGER | |||
| LC4-1 | Growth Inhibition Assay | IC50=40.8716 μM | SANGER | |||
| A388 | Growth Inhibition Assay | IC50=42.5848 μM | SANGER | |||
| NTERA-S-cl-D1 | Growth Inhibition Assay | IC50=42.7074 μM | SANGER | |||
| CESS | Growth Inhibition Assay | IC50=44.2232 μM | SANGER | |||
| RS4-11 | Growth Inhibition Assay | IC50=49.0938 μM | SANGER | |||
| MS-1 | Growth Inhibition Assay | IC50=50.9351 μM | SANGER | |||
| CTV-1 | Growth Inhibition Assay | IC50=51.074 μM | SANGER | |||
| D-502MG | Growth Inhibition Assay | IC50=51.6271 μM | SANGER | |||
| ML-2 | Growth Inhibition Assay | IC50=52.9195 μM | SANGER | |||
| SK-NEP-1 | Growth Inhibition Assay | IC50=53.3923 μM | SANGER | |||
| LOXIMVI | Growth Inhibition Assay | IC50=53.5884 μM | SANGER | |||
| DJM-1 | Growth Inhibition Assay | IC50=56.3391 μM | SANGER | |||
| GI-1 | Growth Inhibition Assay | IC50=56.6149 μM | SANGER | |||
| IST-MES1 | Growth Inhibition Assay | IC50=60.5493 μM | SANGER | |||
| MV-4-11 | Growth Inhibition Assay | IC50=60.6538 μM | SANGER | |||
| OVCAR-4 | Growth Inhibition Assay | IC50=63.5657 μM | SANGER | |||
| KE-37 | Growth Inhibition Assay | IC50=66.2668 μM | SANGER | |||
| D-542MG | Growth Inhibition Assay | IC50=68.4135 μM | SANGER | |||
| MHH-PREB-1 | Growth Inhibition Assay | IC50=72.8441 μM | SANGER | |||
| MRK-nu-1 | Growth Inhibition Assay | IC50=73.4705 μM | SANGER | |||
| D-247MG | Growth Inhibition Assay | IC50=73.5442 μM | SANGER | |||
| OCI-AML2 | Growth Inhibition Assay | IC50=76.9369 μM | SANGER | |||
| LP-1 | Growth Inhibition Assay | IC50=82.8731 μM | SANGER | |||
| HCC1599 | Growth Inhibition Assay | IC50=84.2837 μM | SANGER | |||
| KARPAS-45 | Growth Inhibition Assay | IC50=84.6992 μM | SANGER | |||
| BE-13 | Growth Inhibition Assay | IC50=99.0477 μM | SANGER | |||
| GCIY | Growth Inhibition Assay | IC50=99.0954 μM | SANGER | |||
| BV-173 | Growth Inhibition Assay | IC50=100.325 μM | SANGER | |||
| LB2518-MEL | Growth Inhibition Assay | IC50=100.789 μM | SANGER | |||
| KS-1 | Growth Inhibition Assay | IC50=101.639 μM | SANGER | |||
| MOLT-16 | Growth Inhibition Assay | IC50=104.986 μM | SANGER | |||
| NCI-H1770 | Growth Inhibition Assay | IC50=108.784 μM | SANGER | |||
| NCI-H82 | Growth Inhibition Assay | IC50=110.976 μM | SANGER | |||
| NCCIT | Growth Inhibition Assay | IC50=112.529 μM | SANGER | |||
| KALS-1 | Growth Inhibition Assay | IC50=115.941 μM | SANGER | |||
| LB2241-RCC | Growth Inhibition Assay | IC50=116.679 μM | SANGER | |||
| HH | Growth Inhibition Assay | IC50=117.395 μM | SANGER | |||
| HD-MY-Z | Growth Inhibition Assay | IC50=118.488 μM | SANGER | |||
| EB-3 | Growth Inhibition Assay | IC50=123.094 μM | SANGER | |||
| BL-70 | Growth Inhibition Assay | IC50=123.127 μM | SANGER | |||
| K-562 | Growth Inhibition Assay | IC50=126.245 μM | SANGER | |||
| HT-144 | Growth Inhibition Assay | IC50=133.164 μM | SANGER | |||
| PF-382 | Growth Inhibition Assay | IC50=134.361 μM | SANGER | |||
| RPMI-8226 | Growth Inhibition Assay | IC50=135.045 μM | SANGER | |||
| NCI-H1355 | Growth Inhibition Assay | IC50=135.587 μM | SANGER | |||
| LXF-289 | Growth Inhibition Assay | IC50=139.781 μM | SANGER | |||
| NCI-H69 | Growth Inhibition Assay | IC50=142.932 μM | SANGER | |||
| SK-MEL-1 | Growth Inhibition Assay | IC50=147.13 μM | SANGER | |||
| KARPAS-299 | Growth Inhibition Assay | IC50=149.12 μM | SANGER | |||
| GB-1 | Growth Inhibition Assay | IC50=149.322 μM | SANGER | |||
| CMK | Growth Inhibition Assay | IC50=149.515 μM | SANGER | |||
| MPP-89 | Growth Inhibition Assay | IC50=156.035 μM | SANGER | |||
| KU812 | Growth Inhibition Assay | IC50=161.902 μM | SANGER | |||
| REH | Growth Inhibition Assay | IC50=162.125 μM | SANGER | |||
| NEC8 | Growth Inhibition Assay | IC50=165.026 μM | SANGER | |||
| KP-N-YS | Growth Inhibition Assay | IC50=168.395 μM | SANGER | |||
| Ramos-2G6-4C10 | Growth Inhibition Assay | IC50=169.915 μM | SANGER | |||
| Becker | Growth Inhibition Assay | IC50=174.18 μM | SANGER | |||
| LB647-SCLC | Growth Inhibition Assay | IC50=175.845 μM | SANGER | |||
| LU-139 | Growth Inhibition Assay | IC50=178.019 μM | SANGER | |||
| QIMR-WIL | Growth Inhibition Assay | IC50=179.646 μM | SANGER | |||
| NCI-H1395 | Growth Inhibition Assay | IC50=179.996 μM | SANGER | |||
| NOMO-1 | Growth Inhibition Assay | IC50=182.85 μM | SANGER | |||
| GI-ME-N | Growth Inhibition Assay | IC50=187.969 μM | SANGER | |||
| KMS-12-PE | Growth Inhibition Assay | IC50=189.273 μM | SANGER | |||
| Daudi | Growth Inhibition Assay | IC50=191.128 μM | SANGER | |||
| LB996-RCC | Growth Inhibition Assay | IC50=191.699 μM | SANGER | |||
| NCI-H2107 | Growth Inhibition Assay | IC50=193.739 μM | SANGER | |||
| SK-PN-DW | Growth Inhibition Assay | IC50=194.719 μM | SANGER | |||
| MC-CAR | Growth Inhibition Assay | IC50=202.253 μM | SANGER | |||
| SNB75 | Growth Inhibition Assay | IC50=221.94 μM | SANGER | |||
| ES4 | Growth Inhibition Assay | IC50=223.783 μM | SANGER | |||
| KARPAS-422 | Growth Inhibition Assay | IC50=228.352 μM | SANGER | |||
| NCI-H1648 | Growth Inhibition Assay | IC50=229.489 μM | SANGER | |||
| ES6 | Growth Inhibition Assay | IC50=239.43 μM | SANGER | |||
| KNS-81-FD | Growth Inhibition Assay | IC50=241.197 μM | SANGER | |||
| JAR | Growth Inhibition Assay | IC50=256.225 μM | SANGER | |||
| NB1 | Growth Inhibition Assay | IC50=260.516 μM | SANGER | |||
| D-336MG | Growth Inhibition Assay | IC50=260.698 μM | SANGER | |||
| BC-3 | Growth Inhibition Assay | IC50=265.178 μM | SANGER | |||
| HCC2218 | Growth Inhibition Assay | IC50=266.415 μM | SANGER | |||
| TE-9 | Growth Inhibition Assay | IC50=266.627 μM | SANGER | |||
| LB1047-RCC | Growth Inhibition Assay | IC50=266.753 μM | SANGER | |||
| CTB-1 | Growth Inhibition Assay | IC50=269.973 μM | SANGER | |||
| NB7 | Growth Inhibition Assay | IC50=271 μM | SANGER | |||
| ST486 | Growth Inhibition Assay | IC50=277.412 μM | SANGER | |||
| HCC1187 | Growth Inhibition Assay | IC50=282.811 μM | SANGER | |||
| NCI-SNU-16 | Growth Inhibition Assay | IC50=284.248 μM | SANGER | |||
| COR-L279 | Growth Inhibition Assay | IC50=291.584 μM | SANGER | |||
| ES8 | Growth Inhibition Assay | IC50=294.182 μM | SANGER | |||
| U-698-M | Growth Inhibition Assay | IC50=298.243 μM | SANGER | |||
| HEL | Growth Inhibition Assay | IC50=309.149 μM | SANGER | |||
| KINGS-1 | Growth Inhibition Assay | IC50=310.674 μM | SANGER | |||
| KY821 | Growth Inhibition Assay | IC50=336.595 μM | SANGER | |||
| MZ1-PC | Growth Inhibition Assay | IC50=345.618 μM | SANGER | |||
| LS-411N | Growth Inhibition Assay | IC50=354.66 μM | SANGER | |||
| SIG-M5 | Growth Inhibition Assay | IC50=359.782 μM | SANGER | |||
| HT | Growth Inhibition Assay | IC50=367.711 μM | SANGER | |||
| HC-1 | Growth Inhibition Assay | IC50=367.787 μM | SANGER | |||
| NCI-H1694 | Growth Inhibition Assay | IC50=372.934 μM | SANGER | |||
| BB65-RCC | Growth Inhibition Assay | IC50=376.245 μM | SANGER | |||
| HAL-01 | Growth Inhibition Assay | IC50=379.838 μM | SANGER | |||
| ARH-77 | Growth Inhibition Assay | IC50=394.008 μM | SANGER | |||
| MZ7-mel | Growth Inhibition Assay | IC50=397.233 μM | SANGER | |||
| SIMA | Growth Inhibition Assay | IC50=403.933 μM | SANGER | |||
| DG-75 | Growth Inhibition Assay | IC50=415.698 μM | SANGER | |||
| HUTU-80 | Growth Inhibition Assay | IC50=419.185 μM | SANGER | |||
| KNS-42 | Growth Inhibition Assay | IC50=425.815 μM | SANGER | |||
| SH-4 | Growth Inhibition Assay | IC50=427.565 μM | SANGER | |||
| L-540 | Growth Inhibition Assay | IC50=431.031 μM | SANGER | |||
| NB10 | Growth Inhibition Assay | IC50=441.234 μM | SANGER | |||
| ES1 | Growth Inhibition Assay | IC50=452.753 μM | SANGER | |||
| KMOE-2 | Growth Inhibition Assay | IC50=456.711 μM | SANGER | |||
| MC116 | Growth Inhibition Assay | IC50=458.116 μM | SANGER | |||
| RCC10RGB | Growth Inhibition Assay | IC50=460.005 μM | SANGER | |||
| RL95-2 | Growth Inhibition Assay | IC50=460.237 μM | SANGER | |||
| Raji | Growth Inhibition Assay | IC50=468.143 μM | SANGER | |||
| CAS-1 | Growth Inhibition Assay | IC50=472.073 μM | SANGER | |||
| Calu-6 | Growth Inhibition Assay | IC50=475.265 μM | SANGER | |||
| KG-1 | Growth Inhibition Assay | IC50=478.44 μM | SANGER | |||
| LB771-HNC | Growth Inhibition Assay | IC50=482.232 μM | SANGER | |||
| ACN | Growth Inhibition Assay | IC50=493.599 μM | SANGER | |||
| KM12 | Growth Inhibition Assay | IC50=496.589 μM | SANGER | |||
| U2OS | Function assay | Binding affinity to wild type Smo expressed in U2OS cells by scintillation counting, Kd = 0.0124 μM. | 23063522 | |||
| U2OS | Function assay | 2 hrs | Displacement of [3H]cyclopamine from wild type Smo expressed in U2OS cells after 2 hrs by scintillation counting, Ki = 0.0127 μM. | 23063522 | ||
| TM3 | Function assay | 48 hrs | Inhibition of Hedgehog signaling pathway in mouse TM3 cells bearing pTA-8xGli-Luc reporter construct assessed as transcriptional modulation of Gli after 48 hrs by luciferase assay, IC50 = 0.046 μM. | 19091559 | ||
| HCC827 | Function assay | Displacement of [3H]-cyclopamine from SMO V404M mutant in gefitinib resistant human HCC827 cells by scintillation counting, Ki = 0.051 μM. | 28787156 | |||
| HEK293 | Function assay | 2 hrs | Displacement of BODIPY-labelled cyclopamine from human Smo receptor expressed in HEK293 cells after 2 hrs by fluorescence microscopy, IC50 = 0.064 μM. | 22268551 | ||
| Shh Light2 | Function assay | 30 hrs | Inhibition of hedgehog signaling pathway in mouse Shh Light2 cells assessed as inhibition of sonic hedgehog-induced GLI1-mediated transcriptional activity measured after 30 hrs by dual luciferase reporter gene assay, IC50 = 0.0741 μM. | 27567371 | ||
| U2OS | Function assay | Binding affinity to Smo D473H mutant expressed in U2OS cells by scintillation counting, Kd = 0.116 μM. | 23063522 | |||
| DaOY | Function assay | 48 hrs | Inhibition of Hedgehog signaling in human DaOY cells assessed as downregulation of Gli1 mRNA expression after 48 hrs by RT-PCR analysis, IC50 = 0.16 μM. | 24900716 | ||
| U2OS | Function assay | 2 hrs | Displacement of [3H]cyclopamine from Smo D473H mutant expressed in U2OS cells after 2 hrs by scintillation counting, Ki = 0.232 μM. | 23063522 | ||
| CHO | Function assay | Antagonist activity at human Smo receptor expressed in CHO cells by [3H]Hh-Ag binding assay, IC50 = 0.28 μM. | 19091559 | |||
| Shh Light2 | Function assay | 40 hrs | Inhibition of SHH pathway in mouse Shh Light2 cells after 40 hrs by Gli-dependent luciferase reporter gene assay, IC50 = 0.3 μM. | 21592788 | ||
| Shh-light2 | Function assay | Inhibition of Smo-mediated Hh signaling in human Shh-light2 cells by luciferase reporter gene assay, IC50 = 0.3 μM. | 22268551 | |||
| M210B4 | Function assay | 24 hrs | Inhibition of Hedgehog signaling in mouse M210B4 cells assessed as downregulation of Ptch mRNA expression after 24 hrs by RT-PCR analysis, IC50 = 0.43 μM. | 24900716 | ||
| Shh-Light 2 | Function assay | 2 days | Antagonist activity at Smo in mouse Shh-Light 2 cells assessed as inhibition of Shh-induced Gli1-reporter activity after 2 days by dual-luciferase reporter gene method, IC50 = 0.484 μM. | 23063522 | ||
| Shh Light2 | Function assay | Inhibition of SHH in mouse Shh Light2 cells by GLI-responsive firefly luciferase reporter gene assay, EC50 = 0.5 μM. | 19309080 | |||
| C3H10T1/2 | Function assay | Inhibition of N-terminal SHH activated pathway in mouse C3H10T1/2 cells assessed as SAG-induced cell differentiation by alkaline phosphatase assay, IC50 = 0.6 μM. | 21592788 | |||
| C3H10T1/2 | Function assay | 6 hrs | Inhibition of SAG-induced differentiation of mouse mesenchymal pluripotent C3H10T1/2 cells to alkaline phosphatase positive oeseoblasts after 6 hrs, IC50 = 0.62 μM. | 22268551 | ||
| ASZ001 | Function assay | 48 hrs | Inhibition of Hedgehog signaling in mouse ASZ001 cells assessed as downregulation of Gli1 mRNA expression after 48 hrs by RT-PCR analysis, IC50 = 0.66 μM. | 24900716 | ||
| M210B4 | Function assay | 24 hrs | Inhibition of Hedgehog signaling in mouse M210B4 cells assessed as downregulation of Gli1 mRNA expression after 24 hrs by RT-PCR analysis, IC50 = 0.8 μM. | 24900716 | ||
| medulloblastoma cells | Antiproliferative assay | Antiproliferative activity against mouse medulloblastoma cells harboring heterozygous ptch1 gene by MTT assay, EC50 = 1 μM. | 17417631 | |||
| CHO | Function assay | Antagonist activity at mouse Smo receptor expressed in CHO cells by [3H]Hh-Ag binding assay, IC50 = 1.2 μM. | 19091559 | |||
| Shh-Light2 | Function assay | 48 hrs | Inhibition of SHH in mouse Shh-Light2 cells after 48 hrs by Gli1 reporter gene assay in presence of SAG, IC50 = 1.312 μM. | 19541490 | ||
| MEF | Function assay | Inhibition of Smo in mouse Ptch-deficient MEF cells assessed as inhibition of Shh-induced Gli1 transcriptional activity, IC50 = 1.5 μM. | 23074541 | |||
| MEF | Function assay | 30 hrs | Inhibition of Smo in mouse Ptch-deficient MEF cells assessed as inhibition of Shh-induced Gli-responsive betagalactosidase activity after 30 hrs by BetaGLo assay, IC50 = 1.9 μM. | 23074541 | ||
| neural precursor cells | Antiproliferative assay | Antiproliferative activity against mouse neural precursor cells by colony formation assay, EC50 = 13.44 μM. | 17417631 | |||
| U87 | Cytotoxicity assay | Cytotoxicity against human U87 cells assessed as viability in presence of beta glucuronidase, IC50 = 15.5 μM. | 20116904 | |||
| U87MG | Antiproliferative assay | 72 hrs | Antiproliferative activity against human U87MG cells after 72 hrs by MTS assay, IC50 = 22.5 μM. | 22226657 | ||
| A549 | Anticancer assay | Anticancer activity against human A549 cells by MTS assay, IC50 = 49 μM. | 18221872 | |||
| DU145 | Growth inhibition assay | 5 uM | 96 hrs | Growth inhibition of human DU145 cells at 5 uM after 96 hrs | 18249125 | |
| DU145 | Growth inhibition assay | 10 uM | 96 hrs | Growth inhibition of human DU145 cells at 10 uM after 96 hrs | 18249125 | |
| HEK293 | Function assay | Inhibition of beta galactosidase in HEK293 cells | 17494766 | |||
| 22Rv | Function assay | Reduction of expression of PTCH mRNA in human 22Rv cells | 17494766 | |||
| PANC1 | Function assay | 0.2 uM | 24 hrs | Inhibition of Hh/GLI1-mediated PTCH mRNA expression in human PANC1 cells at 0.2 uM after 24 hrs by RT-PCR | 20450170 | |
| PANC1 | Function assay | 0.4 uM | 24 hrs | Inhibition of Hh/GLI1-mediated PTCH mRNA expression in human PANC1 cells at 0.4 uM after 24 hrs by RT-PCR | 20450170 | |
| Shh Light2 | Function assay | 6.25 uM | 30 hrs | Inhibition of N-palmitoylated Shh in mouse Shh Light2 cells at 6.25 uM after 30 hrs by firefly luciferase reporter gene assay | 19151731 | |
| U87MG | Function assay | 10 uM | 4 hrs | Inhibition of Hedgehog signaling pathway in human U87MG cells assessed as down regulation of Gli1 at 10 uM after 4 hrs by RT-PCR analysis | 22226657 | |
| HEK293 | Function assay | 5 uM | 10 hrs | Displacement of BODIPY-cyclopamine from human Smo expressed in HEK293 cells at 5 uM measured after 10 hrs by DAPI staining based fluorescence microscopic assay | 27736063 | |
| HEK293 | Function assay | 5 uM | 10 hrs | Displacement of BODIPY-cyclopamine from human Smo expressed in HEK293 cells at 5 uM measured after 10 hrs by FACS analysis | 27736063 | |
| C3H10T1/2 | Function assay | 55.5 to 4500 nM | Competitive inhibition of Smo in mouse C3H10T1/2 cells assessed as inhibition of SAG-induced Gli1 transcriptional activity at 55.5 to 4500 nM by qPCR analysis | 23074541 | ||
| U2OS | Function assay | 5 uM | 6 hrs | Antagonist activity at chimeric Smo 633 mutant expressed in U2OS cells coexpressing beta arrestin2-GFP assessed as inhibition of intracellular beta arrestin2-GFP aggregate formation at 5 uM after 6 hrs by confocal microscopy | 23063522 | |
| Klicken Sie hier, um weitere experimentelle Daten zu Zelllinien anzuzeigen | ||||||
Chemische Informationen, Lagerung & Stabilität
| Molekulargewicht | 411.62 | Formel | C27H41NO2 |
Lagerung (Ab dem Eingangsdatum) | |
|---|---|---|---|---|---|
| CAS-Nr. | 4449-51-8 | SDF herunterladen | Lagerung von Stammlösungen |
|
|
| Synonyme | 11-deoxojervine | Smiles | CC1CC2C(C(C3(O2)CCC4C5CC=C6CC(CCC6(C5CC4=C3C)C)O)C)NC1 | ||
Löslichkeit
|
In vitro |
Ethanol : 28 mg/mL
DMSO
: Insoluble
Water : Insoluble |
Molaritätsrechner
|
In vivo |
|||||
In-vivo-Formulierungsrechner (Klare Lösung)
Schritt 1: Geben Sie die untenstehenden Informationen ein (Empfohlen: Ein zusätzliches Tier zur Berücksichtigung von Verlusten während des Experiments)
Schritt 2: Geben Sie die In-vivo-Formulierung ein (Dies ist nur der Rechner, keine Formulierung. Bitte kontaktieren Sie uns zuerst, wenn es im Abschnitt "Löslichkeit" keine In-vivo-Formulierung gibt.)
Berechnungsergebnisse:
Arbeitskonzentration: mg/ml;
Methode zur Herstellung der DMSO-Stammlösung: mg Wirkstoff vorgelöst in μL DMSO ( Konzentration der Stammlösung mg/mL, Bitte kontaktieren Sie uns zuerst, wenn die Konzentration die DMSO-Löslichkeit der Wirkstoffcharge überschreitet. )
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügenμL PEG300, mischen und klären, dann hinzufügenμL Tween 80, mischen und klären, dann hinzufügen μL ddH2O, mischen und klären.
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügen μL Maisöl, mischen und klären.
Hinweis: 1. Bitte stellen Sie sicher, dass die Flüssigkeit klar ist, bevor Sie das nächste Lösungsmittel hinzufügen.
2. Achten Sie darauf, das/die Lösungsmittel der Reihe nach hinzuzufügen. Sie müssen sicherstellen, dass die bei der vorherigen Zugabe erhaltene Lösung eine klare Lösung ist, bevor Sie mit der Zugabe des nächsten Lösungsmittels fortfahren. Physikalische Methoden wie Vortex, Ultraschall oder ein heißes Wasserbad können zur Unterstützung des Lösens verwendet werden.
Wirkmechanismus
| Targets/IC50/Ki |
Smoothened
(TM3Hh12 cells) 46 nM
|
|---|---|
| In vitro |
Cyclopamine hemmt den Hedgehog-Signalweg mit einem IC50 von 46 nM und blockiert die Aktivität des menschlichen Smo-Rezeptors, der in CHO-K1-Zellen im [3H]Hh-Ag-Bindungsassay exprimiert wird, mit einem IC50 von 280 nM. Diese Verbindung hemmt die Aktivität des Hedgehog-Signalwegs dosisabhängig in von Darm abgeleiteten Tumorzelllinien, die Patched (PTCH)-mRNA exprimieren, und induziert eine Wachstumshemmung dieser Tumorzelllinien um 75-95% bei einer Konzentration von 3 μM, ist jedoch unwirksam gegenüber Kolontumorzellen ohne PTCH-mRNA-Expression, was darauf hindeutet, dass die Wirkungen dieser chemischen Behandlung eher mit dem Hedgehog-Signalweg zusammenhängen als generell zytotoxisch sind. Durch die Blockierung der Hedgehog-Signalübertragung durch direkte Interaktion mit Smo hemmt es (10 μM) die Proliferation von SMOhigh Cyclopamine-responsiven Zelllinien L3.6sl und Panc 05.04 um 75-80% und erhöht die Apoptose um das 2,5- bis 3,5-fache, ohne die BxPC3-SMOlow-Zelllinie zu beeinflussen. Diese Behandlung verringert signifikant die Snail-mRNA und erhöht die E-Cadherin-Transkripte in der E3LZ10.7-Zelllinie. Unabhängig von der Hemmung des Zellwachstums hemmt es signifikant den invasiven Phänotyp von Hedgehog-abhängigen L3.6pl-Zellen, was zu einer >500-fachen Reduzierung der Anzahl der transmigrierenden Zellen führt, aber nicht den der Hedgehog-unabhängigen Zelllinie Panc-1.
|
| Kinase-Assay |
Hedgehog-Zell-Assay
|
|
Dieser Assay misst das Endstadium des Hh-Signalwegs, d.h. die transkriptionelle Modulation von Gli, unter Verwendung von Luciferase als Ablesung (Gli-Luc-Assay). Cyclopamine wird für den Assay durch serielle Verdünnung in DMSO vorbereitet und dann zu leeren Assayplatten gegeben. TM3Hh12-Zellen (TM3-Zellen, die das Hh-responsive Reportergenkonstrukt pTA-8xGli-Luc enthalten) werden in F12 Ham's/DMEM (1:1) mit 5% FBS und 15 mM Hepes pH 7,3 resuspendiert, zu den Assayplatten gegeben und etwa 30 Minuten lang bei 37 °C in 5% CO2 mit dieser Verbindung inkubiert. Anschließend wird 1 nM Hh-Ag 1.5 zu den Assayplatten gegeben und bei 37 °C in Gegenwart von 5% CO2 inkubiert. Nach 48 Stunden wird entweder Bright-Glo oder MTS-Reagenz zu den Assayplatten gegeben und die Lumineszenz oder Absorption bei 492 nm bestimmt. Der IC50-Wert, definiert als der Wendepunkt der logistischen Kurve, wird durch nicht-lineare Regression der Gli-gesteuerten Luciferase-Lumineszenz oder des Absorptionssignals aus dem MTS-Assay gegen log10 (Konzentration) dieser Chemikalie unter Verwendung des statistischen Softwarepakets R bestimmt.
|
|
| In vivo |
Die Verabreichung von Cyclopamine in einer Dosis von 50 mg/kg/Tag über 22 Tage beseitigt die HUCCT1-Xenotransplantate bei Mäusen ohne offensichtliche Nebenwirkungen. Diese Verbindungstherapie in einer Dosis von 1,2 mg über 7 Tage induziert eine signifikante Apoptose von Tumorzellen und verringert die Tumormasse um 50-60% in von Panc 05.04- und L3.6sl-abgeleiteten Tumoren, jedoch nicht in den BxPC3-SMOlow-Tumoren. [3] Die alleinige Verabreichung dieser Chemikalie hemmt die Tumormetastasierung in Xenotransplantaten von E3LZ10.7 und L3.6pl erheblich und hebt die Metastasierung in Kombination mit Gemcitabin vollständig auf.
|
Literatur |
|
Anwendungen
| Methoden | Biomarker | Bilder | PMID |
|---|---|---|---|
| Western blot | Snail / E-cadherin / Slug / Vimentin Gli1 / TGF-β1 / CXCR4 NF-κB / Cyclin D1 / MMP2 / MMP9 |
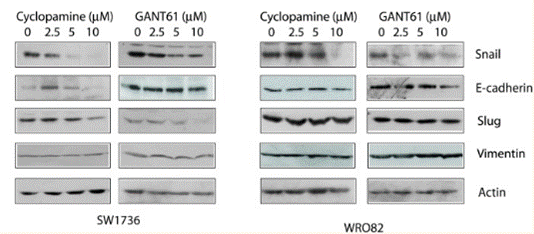
|
26859575 |
| Immunofluorescence | PCNA / β-catenin Vimentin |
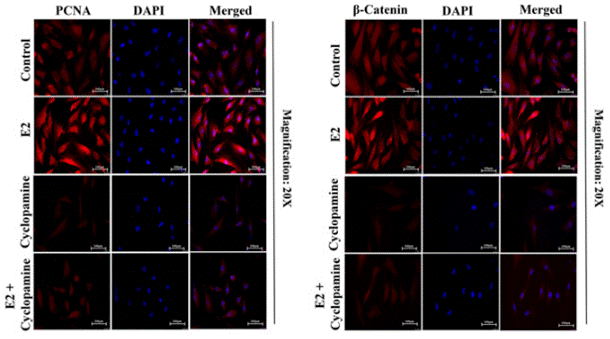
|
28747625 |
Technischer Support
Tel: +1-832-582-8158 Ext:3
Wenn Sie weitere Fragen haben, hinterlassen Sie bitte eine Nachricht.
Häufig gestellte Fragen
Frage 1:
How to reconstitute it for in vivo use in mice?
Antwort:
One paper dissolved this compound in DMSO, and diluted it in saline: Berman DM, et al. Nature, 2003, 425(6960), 846-851. Alternatively, you can try this vehicle: 10% DMSO+30% PEG 300+5% Tween 80+ddH2O for P.O. When preparing the solution, please dissolve it in DMSO clearly first. Then add PEG300 and Tween, after they mixed well, dilute with water.
