nur für Forschungszwecke
Alvespimycin (17-DMAG) Hydrochloride HSP Inhibitor
Kat.-Nr.S1142
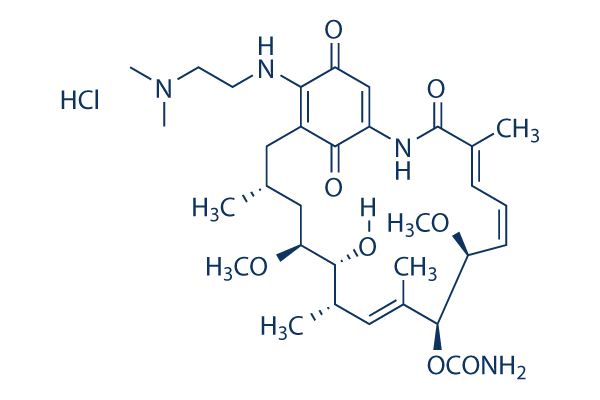
Chemische Struktur
Molekulargewicht: 653.21
Qualitätskontrolle
Zellkultur, Behandlung & Arbeitskonzentration
| Zelllinien | Assay-Typ | Konzentration | Inkubationszeit | Formulierung | Aktivitätsbeschreibung | PMID |
|---|---|---|---|---|---|---|
| MDA-MB-231 | Function assay | Inhibition of Hsp90 in human MDA-MB-231 cells assessed as her2 degradation, IC50=0.0045μM. | 18929486 | |||
| A2058 | Cytotoxicity assay | Cytotoxicity against human A2058 cells by MTT assay, IC50=0.0021μM. | 18929486 | |||
| AGS | Cytotoxicity assay | Cytotoxicity against human AGS cells by MTT assay, IC50=16μM. | 18359631 | |||
| HeLa | Cytotoxicity assay | Cytotoxicity against human HeLa cells by MTT assay, IC50=2.06μM. | 18359631 | |||
| HeLa | Function assay | Inhibition of TNF-alpha-induced NF-kappaB activation in human HeLa cells, IC50=0.15μM. | 18359631 | |||
| AGS | Function assay | Inhibition of hypoxia-induced HIF1 activation in human AGS cells by reporter gene assay, IC50=0.0036μM. | 18359631 | |||
| NCI-H526 | Function assay | 1 uM | 96 hrs | Inhibition of HSP90-mediated proliferation of human NCI-H526 cells at 1 uM after 96 hrs by sulforhodamine B assay | 17603540 | |
| NCI-H526 | Function assay | 1 uM | 24 hrs | Binding affinity to HSP90 in human NCI-H526 cells at 1 uM after 24 hrs by fluorescence polarization assay | 17603540 | |
| AGS | Function assay | 24 hrs | Viability of human AGS cells under normoxic conditions after 24 hrs by MTT assay, IC50=16μM. | 17583950 | ||
| Hep3B | Function assay | 16 hrs | Inhibition of HIF1 activation in human Hep3B cells assessed as inhibition of hypoxia-induced luciferase expression after 16 hrs by reporter assay, IC50=0.061μM. | 17583950 | ||
| AGS | Function assay | 16 hrs | Inhibition of HIF1 activation in human AGS cells assessed as inhibition of hypoxia-induced luciferase expression after 16 hrs by reporter assay, IC50=0.036μM. | 17583950 | ||
| SKOV3 | Function assay | Degradation of Her2 in SKOV3 cells, EC50=0.046μM. | 16854066 | |||
| SKOV3 | Function assay | Upregulation of Hsp70 in SKOV3 cells, EC50=0.014μM. | 16854066 | |||
| SKBR3 | Function assay | Degradation of Her2 in SKBR3 cells, EC50=0.008μM. | 16854066 | |||
| SKBR3 | Function assay | Upregulation of Hsp70 in SKBR3 cells, EC50=0.004μM. | 16854066 | |||
| SKBr3 | Cytotoxicity assay | Cytotoxicity against SKBr3 cells, IC50=0.024μM. | 16165354 | |||
| MDA-MB-231 | Cytotoxicity assay | Cytotoxicity against human MDA-MB-231 cells by MTT assay, IC50=0.0058μM. | 18929486 | |||
| A2058 | Function assay | Inhibition of Hsp90 in human A2058 cells, EC50=0.0079μM. | 18929486 | |||
| MDA-MB-231 | Function assay | Inhibition of Hsp90 in human MDA-MB-231 cells assessed as Akt degradation, IC50=0.0176μM. | 18929486 | |||
| A2058 | Function assay | Inhibition of Hsp90 in human A2058 cells assessed as Akt degradation, IC50=0.0243μM. | 18929486 | |||
| HuH7 | Antiviral assay | 3 days | Antiviral activity against Hepatitis C virus genotype 1b Con1 infected in human HuH7 cells assessed as GAPDH RNA or 18S rRNA level after 3 days by qRT-PCR analysis, EC50=0.0012μM. | 18936191 | ||
| HuH7 | Antiviral assay | 3 days | Antiviral activity against Hepatitis C virus genotype 1b Con1 infected in human HuH7 cells assessed as GAPDH RNA or 18S rRNA level after 3 days selected with 40 nM HCV-796 and 800 nM boceprevir by qRT-PCR analysis, EC50=0.0031μM. | 18936191 | ||
| SKBR3 | Function assay | Binding affinity to Hsp90 in human SKBR3 cells, IC50=0.024μM. | 19017562 | |||
| Hep3B | Function assay | 30 mins | Inhibition of hypoxia-induced HIF1alpha protein accumulation in human Hep3B cells treated for 30 mins measured after 12 hrs by Western blot analysis, IC50=0.0572μM. | 19072214 | ||
| Hep3B | Function assay | 16 hrs | Inhibition of hypoxia-induced VEGF protein secretion in human Hep3B cells after 16 hrs by ELISA, IC50=0.0795μM. | 19072214 | ||
| HCT116 | Cytotoxicity assay | 72 hrs | Cytotoxicity against human HCT116 cells after 72 hrs, IC50=0.057μM. | 19231864 | ||
| SKBR3 | Cytotoxicity assay | 72 hrs | Cytotoxicity against human SKBR3 cells after 72 hrs, IC50=0.058μM. | 19231864 | ||
| MCF7 | Cytotoxicity assay | 72 hrs | Cytotoxicity against human MCF7 cells after 72 hrs, IC50=0.071μM. | 19231864 | ||
| SKOV3 | Cytotoxicity assay | 72 hrs | Cytotoxicity against human SKOV3 cells after 72 hrs, IC50=0.122μM. | 19231864 | ||
| SKBR3 | Cytotoxicity assay | 72 hrs | Cytotoxicity against human SKBR3 cells after 72 hrs in presence of NQO1 inhibitor dicoumarol, IC50=0.23μM. | 19231864 | ||
| MCF7 | Cytotoxicity assay | 72 hrs | Cytotoxicity against human MCF7 cells after 72 hrs in presence of NQO1 inhibitor dicoumarol, IC50=0.862μM. | 19231864 | ||
| NCI-H596 | Cytotoxicity assay | 72 hrs | Cytotoxicity against NQ01-deficient human NCI-H596 cells after 72 hrs, IC50=1.1μM. | 19231864 | ||
| MDA468 | Cytotoxicity assay | 72 hrs | Cytotoxicity against NQ01-deficient human MDA468 cells after 72 hrs, IC50=1.6μM. | 19231864 | ||
| SKBR3 | Cytotoxicity assay | 72 hrs | Cytotoxicity against human SKBR3 cells after 72 hrs by celltiter-glo assay, IC50=0.024μM. | 19405528 | ||
| A549 | Cytotoxicity assay | 72 hrs | Cytotoxicity against human A549 cells after 72 hrs by celltiter-glo assay, IC50=0.068μM. | 19405528 | ||
| SKOV3 | Cytotoxicity assay | 72 hrs | Cytotoxicity against human SKOV3 cells after 72 hrs by celltiter-glo assay, IC50=0.22μM. | 19405528 | ||
| MCF7 | Cytotoxicity assay | 72 hrs | Cytotoxicity against human MCF7 cells after 72 hrs by celltiter-glo assay, IC50=0.23μM. | 19405528 | ||
| CCRF-CEM | Cytotoxicity assay | 72 hrs | Cytotoxicity against human CCRF-CEM cells after 72 hrs by celltiter-96 aqueous one solution assay, IC50=0.54μM. | 19405528 | ||
| CCRF-CEM | Cytotoxicity assay | 72 hrs | Cytotoxicity against human paclitaxel-resistant CCRF-CEM cells after 72 hrs by celltiter-96 aqueous one solution assay, IC50=2.5μM. | 19405528 | ||
| Hep3B | Function assay | 30 mins | Inhibition of hypoxia-induced HIF1alpha protein accumulation in human Hep3B cells treated for 30 mins measured after 12 hrs by Western blot analysis, IC50=0.057μM. | 20469887 | ||
| Hep3B | Function assay | 16 hrs | Inhibition of hypoxia-induced VEGF protein secretion in human Hep3B cells after 16 hrs by ELISA, IC50=0.079μM. | 20469887 | ||
| HCT116 | Cytotoxicity assay | Cytotoxicity against human HCT116 cells by Alamar blue assay, IC50=0.05μM. | 20662534 | |||
| NCI-H1299 | Function assay | 24 hrs | Inhibition of human HSP90 in human NCI-H1299 cells assessed as Akt degradation after 24 hrs by luminex assay, IC50=0.1μM. | 21438541 | ||
| LN229-Lux | Function assay | 2.5 to 10 uM | 1 hr | Inhibition of luciferase activity in human LN229-Lux cells at 2.5 to 10 uM incubated for 1 hr under normoxia followed by 24 hrs under hypoxia by reporter gene assay | 22746274 | |
| MCF7 | Antiproliferative assay | 48 hrs | Antiproliferative activity against human MCF7 cells assessed as inhibition of cell viability after 48 hrs by MTT assay, IC50=0.39μM. | 24582477 | ||
| HCT116 | Antiproliferative assay | 48 hrs | Antiproliferative activity against human HCT116 cells assessed as inhibition of cell viability after 48 hrs by MTT assay, IC50=0.78μM. | 24582477 | ||
| SKBR3 | Antiproliferative assay | 48 hrs | Antiproliferative activity against human SKBR3 cells assessed as inhibition of cell viability after 48 hrs by MTT assay, IC50=1.34μM. | 24582477 | ||
| A231 | Antiproliferative assay | 48 hrs | Antiproliferative activity against human A231 cells after 48 hrs by MTT assay, IC50=0.17μM. | 24763261 | ||
| MCF7 | Antiproliferative assay | 48 hrs | Antiproliferative activity against human MCF7 cells after 48 hrs by MTT assay, IC50=0.8μM. | 24763261 | ||
| HCT116 | Antiproliferative assay | 48 hrs | Antiproliferative activity against human HCT116 cells after 48 hrs by MTT assay, IC50=1.21μM. | 24763261 | ||
| SKBR3 | Antiproliferative assay | 48 hrs | Antiproliferative activity against human SKBR3 cells after 48 hrs by MTT assay, IC50=3.11μM. | 24763261 | ||
| NCI-H1299 | Function assay | 12 hrs | Reduction in oxygen consumption rate in human NCI-H1299 cells incubated for 12 hrs | 25383915 | ||
| PC9 | Cytotoxicity assay | 72 hrs | Cytotoxicity against HGF-induced erlotinib-resistant human PC9 cells assessed as inhibition of cell growth after 72 hrs by MTT assay, IC50=0.01μM. | 26844689 | ||
| Ma1 | Cytotoxicity assay | 72 hrs | Cytotoxicity against HGF-induced erlotinib-resistant human Ma1 cells assessed as inhibition of cell growth after 72 hrs by MTT assay, IC50=0.01μM. | 26844689 | ||
| SKBR3 | Function assay | Inhibition of Hsp90 in human SKBR3 cells, IC50=0.024μM. | 26844689 | |||
| HeLa | Function assay | 10 uM | 6 hrs | Inhibition of HSP90 in human HeLa cells assessed as induction of chk1 degradation at 10 uM after 6 hrs by Western blot method | 28816449 | |
| HeLa | Function assay | 10 uM | 6 hrs | Inhibition of HSP90 in human HeLa cells assessed as induction of Akt degradation at 10 uM after 6 hrs by Western blot method | 28816449 | |
| HeLa | Function assay | 10 uM | 6 hrs | Inhibition of HSP90 in human HeLa cells assessed as induction of HSP70 protein expression at 10 uM after 6 hrs by Western blot method | 28816449 | |
| PC3 | Function assay | 10 uM | 6 hrs | Inhibition of HSP90 in human PC3 cells assessed as induction of chk1 degradation at 10 uM after 6 hrs by Western blot method | 28816449 | |
| PC3 | Function assay | 10 uM | 6 hrs | Inhibition of HSP90 in human PC3 cells assessed as induction of Akt degradation at 10 uM after 6 hrs by Western blot method | 28816449 | |
| PC3 | Function assay | 10 uM | 6 hrs | Inhibition of HSP90 in human PC3 cells assessed as induction of HSP70 protein expression at 10 uM after 6 hrs by Western blot method | 28816449 | |
| Klicken Sie hier, um weitere experimentelle Daten zu Zelllinien anzuzeigen | ||||||
Chemische Informationen, Lagerung & Stabilität
| Molekulargewicht | 653.21 | Formel | C32H48N4O8•HCl |
Lagerung (Ab dem Eingangsdatum) | |
|---|---|---|---|---|---|
| CAS-Nr. | 467214-21-7 | SDF herunterladen | Lagerung von Stammlösungen |
|
|
| Synonyme | NSC 707545,BMS 826476 HCl,KOS 1022 | Smiles | CC1CC(C(C(C=C(C(C(C=CC=C(C(=O)NC2=CC(=O)C(=C(C1)C2=O)NCCN(C)C)C)OC)OC(=O)N)C)C)O)OC.Cl | ||
Löslichkeit
|
In vitro |
DMSO
: 100 mg/mL
(153.09 mM)
Water : Insoluble Ethanol : Insoluble |
Molaritätsrechner
|
In vivo |
|||||
In-vivo-Formulierungsrechner (Klare Lösung)
Schritt 1: Geben Sie die untenstehenden Informationen ein (Empfohlen: Ein zusätzliches Tier zur Berücksichtigung von Verlusten während des Experiments)
Schritt 2: Geben Sie die In-vivo-Formulierung ein (Dies ist nur der Rechner, keine Formulierung. Bitte kontaktieren Sie uns zuerst, wenn es im Abschnitt "Löslichkeit" keine In-vivo-Formulierung gibt.)
Berechnungsergebnisse:
Arbeitskonzentration: mg/ml;
Methode zur Herstellung der DMSO-Stammlösung: mg Wirkstoff vorgelöst in μL DMSO ( Konzentration der Stammlösung mg/mL, Bitte kontaktieren Sie uns zuerst, wenn die Konzentration die DMSO-Löslichkeit der Wirkstoffcharge überschreitet. )
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügenμL PEG300, mischen und klären, dann hinzufügenμL Tween 80, mischen und klären, dann hinzufügen μL ddH2O, mischen und klären.
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügen μL Maisöl, mischen und klären.
Hinweis: 1. Bitte stellen Sie sicher, dass die Flüssigkeit klar ist, bevor Sie das nächste Lösungsmittel hinzufügen.
2. Achten Sie darauf, das/die Lösungsmittel der Reihe nach hinzuzufügen. Sie müssen sicherstellen, dass die bei der vorherigen Zugabe erhaltene Lösung eine klare Lösung ist, bevor Sie mit der Zugabe des nächsten Lösungsmittels fortfahren. Physikalische Methoden wie Vortex, Ultraschall oder ein heißes Wasserbad können zur Unterstützung des Lösens verwendet werden.
Wirkmechanismus
| Merkmale |
A synthetic derivative Geldanamycin, with lower hepatotoxicity than parent antibiotic & higher potency and bioavailability than the similar derivative 17-AAG.
|
|---|---|
| Targets/IC50/Ki |
HSP90
(Cell-free assay) 62 nM
|
| In vitro |
17-DMAG zeigt eine ~2-fach höhere Potenz gegen menschliches Hsp90 als 17-AAG, mit einer IC50 von 62 nM gegenüber 119 nM. In SKBR3- und SKOV3-Zellen, die das Hsp90-Client-Protein Her2 überexprimieren, verursacht 17-DMAG eine Herunterregulierung von Her2 mit einer EC50 von 8 nM bzw. 46 nM, sowie eine Induktion von Hsp70 mit einer EC50 von 4 nM bzw. 14 nM, was zu einer signifikanten Zytotoxizität mit einer GI50 von 29 nM bzw. 32 nM führt, was mit der Hsp90-Inhibition übereinstimmt. 17-DMAG induziert in Kombination mit Vorinostat synergistisch die Apoptose der kultivierten MCL-Zellen sowie primärer MCL-Zellen, potenter als jeder einzelne Wirkstoff, indem es die Spiegel von Cyclin D1 und CDK4 sowie von c-Myc, c-RAF und Akt deutlich abschwächt. Im Gegensatz zu 17-AAG, das nur für IKKβ in chronischen lymphatischen Leukämie (CLL)-Zellen aktiv ist, führt die 17-DMAG-Behandlung effektiv zu einer Depletion des Hsp90-Client-Proteins, was zu einer verminderten NF-κB p50/p65 DNA-Bindung, einer verringerten NF-κB-Zielgen-Transkription und einer Caspase-abhängigen Apoptose führt. Durch die Targeting der NF-κB-Familie vermittelt 17-DMAG selektiv dosis- und zeitabhängige Zytotoxizität gegen CLL-Zellen, aber nicht gegen normale T-Zellen oder NK-Zellen, die für die Immunüberwachung wichtig sind. |
| Kinase-Assay |
Fluoreszenzpolarisation (FP)-basierter Kompetitionsbindungsassay
|
|
Dieser Assay verwendet ein Bor-Difluorid-Dipyrromethen (BODIPY)-markiertes Geldanamycin-Analogon (BODIPY-AG) als Sonde und misst die Fluoreszenzpolarisation bei der Bindung der Sonde an ein Protein. Nativ menschliches Hsp90-Protein (α + β Isoformen) wird aus HeLa-Zellen isoliert. Die BODIPY-AG-Lösung wird frisch in FP-Assay-Puffer (20 mM HEPES-KOH, pH 7,3, 1,0 mM EDTA, 100 mM KCl, 5,0 mM MgCl2, 0,01 % NP-40, 0,1 mg/mL frisches Rinder-γ-Globulin (BGG), 1,0 mM frisches DTT und Proteaseinhibitor aus Stammlösung in DMSO) hergestellt. Kompetitionskurven werden durch Mischen von je 10 μL einer Lösung, die BODIPY-AG und Hsp90 enthält, und einer seriellen Verdünnung von 17-DMAG, frisch in FP-Assay-Puffer aus Stammlösung in DMSO hergestellt, erhalten. Die Endkonzentrationen sind 10 nM BODIPY-AG, 40 oder 60 nM Hsp90, variierende Konzentrationen von 17-DMAG (0,10 nM-10 μM) und ≤0,25 % DMSO in einer 384-Well-Mikroplatte. Nach 3 Stunden Inkubation bei 30 °C wird die Fluoreszenzanisotropie (γEx = 485 nm, γEm = 535 nm) auf einem EnVision 2100 Multilabel-Plattenlesegerät gemessen. Der IC50-Wert von 17-DMAG wird aus den Kompetitionskurven erhalten.
|
|
| In vivo |
Eine 17-DMAG-Behandlung mit 5 mg/kg oder 25 mg/kg dreimal pro Woche reduziert das Tumorwachstum von TMK-1-Xenotransplantaten signifikant, indem sie die Gefäßfläche und die Anzahl proliferierender Tumorzellen in Schnitten signifikant reduziert. In Übereinstimmung mit der Hemmung der FAK-Signalübertragung in vivo unterdrückt die 17-DMAG-Behandlung mit 25 mg/kg dreimal pro Woche das Tumorwachstum und die Metastasierung von ME180- und SiHa-Xenotransplantaten bei Mäusen signifikant. Die Verabreichung von 17-DMAG mit 10 mg/kg über 16 Tage verringert die Anzahl der weißen Blutkörperchen signifikant und verlängert das Überleben in einem TCL1-SCID-Transplantationsmausmodell. |
Literatur |
|
Anwendungen
| Methoden | Biomarker | Bilder | PMID |
|---|---|---|---|
| Western blot | HSP90 / HSP70 p-Akt / Survivin / MMP2 PARP / Cleaved caspase-3 / Cleaved caspase-8 / Cleaved caspase-9 / PUMA p-ALK / ALK / p-Akt / Akt / p-ERK / ERK α-Tax / α-IKKα / α-IKKβ/ α-NEMO / α-TBK1 / α-p65 / α-p50 |
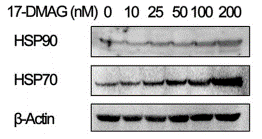
|
28915605 |
| Growth inhibition assay | Cell proliferation |
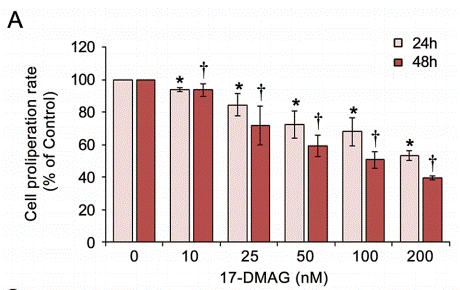
|
28915605 |
Klinische Studieninformationen
(Daten von https://clinicaltrials.gov, aktualisiert am 2024-05-22)
| NCT-Nummer | Rekrutierung | Erkrankungen | Sponsor/Kooperationspartner | Startdatum | Phasen |
|---|---|---|---|---|---|
| NCT00780000 | Terminated | Breast Cancer |
Bristol-Myers Squibb |
April 2008 | Phase 2 |
| NCT00248521 | Unknown status | Unspecified Adult Solid Tumor Protocol Specific |
Institute of Cancer Research United Kingdom|National Cancer Institute (NCI) |
October 2005 | Phase 1 |
Technischer Support
Tel: +1-832-582-8158 Ext:3
Wenn Sie weitere Fragen haben, hinterlassen Sie bitte eine Nachricht.
