nur für Forschungszwecke
Zelavespib (PU-H71) HSP Inhibitor
Kat.-Nr.S8039
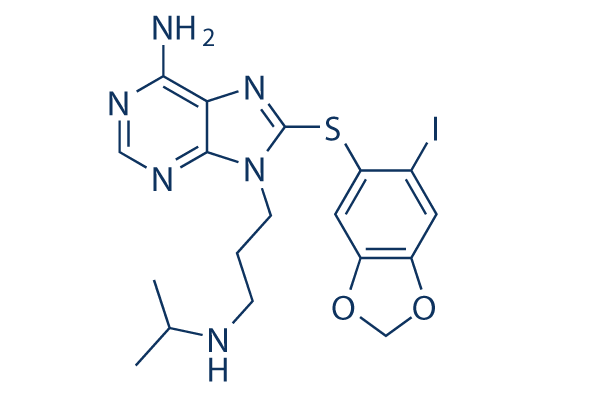
Chemische Struktur
Molekulargewicht: 512.37
Qualitätskontrolle
Zellkultur, Behandlung & Arbeitskonzentration
| Zelllinien | Assay-Typ | Konzentration | Inkubationszeit | Formulierung | Aktivitätsbeschreibung | PMID |
|---|---|---|---|---|---|---|
| MDA-MB-468 cells | Function assay | Inhibitory activity against Hsp90 in human breast cancer MDA-MB-468 cell line, EC50=0.0102 μM | ||||
| SKBr3 cells | Growth inhibition assay | Growth inhibition in human breast cancer SKBr3 cell line using SRB, IC50=0.05 μM | ||||
| MCF7 cells | Function assay | 24 h | Inhibition of Hsp90 in human MCF7 cells assessed as Her2 level after 24 hrs by Western blot, IC50=0.06 μM | |||
| MRC5 cells | Cytotoxicity assay | Cytotoxicity against normal lung fibroblast MRC5 cell line, IC50=1 μM | ||||
| NCI-H1299 cells | Function assay | 12 h | Reduction in oxygen consumption rate in human NCI-H1299 cells incubated for 12 hrs | |||
| NCI-H69 cells | Function assay | 24 h | Binding affinity to HSP90 in human NCI-H69 cells after 24 hrs by fluorescence polarization assay | |||
| NCI-N417 cells | Function assay | 24 h | Binding affinity to HSP90 in human NCI-N417 cells after 24 hrs by fluorescence polarization assay | |||
| NCI-H187 cells | Function assay | 24 h | Binding affinity to HSP90 in human NCI-H187 cells after 24 hrs by fluorescence polarization assay | |||
| NCI-H510 cells | Function assay | 24 h | Binding affinity to HSP90 in human NCI-H510 cells after 24 hrs by fluorescence polarization assay | |||
| SKBR3 cells | Function assay | 24 h | Binding affinity to HSP90 in human SKBR3 cells after 24 hrs by fluorescence polarization assay | |||
| NCI-H526 cells | Function assay | 1 μM | 24 h | Binding affinity to HSP90 in human NCI-H526 cells at 1 uM after 24 hrs by fluorescence polarization assay | ||
| H69AR cells | Function assay | 96 h | Inhibition of HSP90-mediated antiapoptotic activity in human H69AR cells assessed as induction of cell growth arrest at 10 after 96 hrs by propidium iodide staining-based flow cytometry | |||
| NCI-H526 cells | Function assay | 24 h | Binding affinity to HSP90 in human NCI-H526 cells after 24 hrs by fluorescence polarization assay | |||
| Klicken Sie hier, um weitere experimentelle Daten zu Zelllinien anzuzeigen | ||||||
Chemische Informationen, Lagerung & Stabilität
| Molekulargewicht | 512.37 | Formel | C18 H21 I N6 O2 S |
Lagerung (Ab dem Eingangsdatum) | |
|---|---|---|---|---|---|
| CAS-Nr. | 873436-91-0 | -- | Lagerung von Stammlösungen |
|
|
| Synonyme | NSC 750424 | Smiles | CC(C)NCCCN1C2=NC=NC(=C2N=C1SC3=C(C=C4C(=C3)OCO4)I)N | ||
Löslichkeit
|
In vitro |
DMSO
: 100 mg/mL
(195.17 mM)
Ethanol : 100 mg/mL Water : 34 mg/mL |
Molaritätsrechner
|
In vivo |
|||||
In-vivo-Formulierungsrechner (Klare Lösung)
Schritt 1: Geben Sie die untenstehenden Informationen ein (Empfohlen: Ein zusätzliches Tier zur Berücksichtigung von Verlusten während des Experiments)
Schritt 2: Geben Sie die In-vivo-Formulierung ein (Dies ist nur der Rechner, keine Formulierung. Bitte kontaktieren Sie uns zuerst, wenn es im Abschnitt "Löslichkeit" keine In-vivo-Formulierung gibt.)
Berechnungsergebnisse:
Arbeitskonzentration: mg/ml;
Methode zur Herstellung der DMSO-Stammlösung: mg Wirkstoff vorgelöst in μL DMSO ( Konzentration der Stammlösung mg/mL, Bitte kontaktieren Sie uns zuerst, wenn die Konzentration die DMSO-Löslichkeit der Wirkstoffcharge überschreitet. )
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügenμL PEG300, mischen und klären, dann hinzufügenμL Tween 80, mischen und klären, dann hinzufügen μL ddH2O, mischen und klären.
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügen μL Maisöl, mischen und klären.
Hinweis: 1. Bitte stellen Sie sicher, dass die Flüssigkeit klar ist, bevor Sie das nächste Lösungsmittel hinzufügen.
2. Achten Sie darauf, das/die Lösungsmittel der Reihe nach hinzuzufügen. Sie müssen sicherstellen, dass die bei der vorherigen Zugabe erhaltene Lösung eine klare Lösung ist, bevor Sie mit der Zugabe des nächsten Lösungsmittels fortfahren. Physikalische Methoden wie Vortex, Ultraschall oder ein heißes Wasserbad können zur Unterstützung des Lösens verwendet werden.
Wirkmechanismus
| Merkmale |
Purine-based, HSP90-selective inhibitor.
|
|---|---|
| Targets/IC50/Ki |
HSP90
51 nM
|
| In vitro |
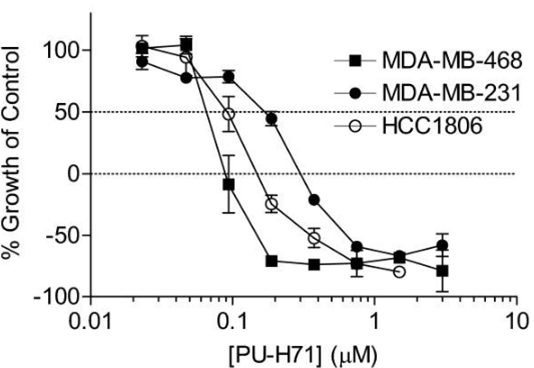
Zelavespib (PU-H71) (1 μM) unterdrückt wirksam das Wachstum von dreifach-negativen Brustkrebs- (TNBC) Zelllinien MDA-MB-468, MDA-MB-231 und HCC-1806 mit IC50-Werten von 65, 140 bzw. 87 nM. Es tötet 80 %, 65 % und 80 % der Ausgangspopulation von MDA-MB-468-, MDA-MB-231- bzw. HCC-1806-Zellen ab. Diese Verbindung (0,25–1 μM) induziert eine dosisabhängige Degradation oder Inaktivierung von tumorfördernden Molekülen, einschließlich EGFR, IGF1R, HER3, c-Kit, Raf-1 und Akt. Eine 24-stündige Behandlung mit 1 μM PU-H71 erhöht den Prozentsatz der Zellen in der G2-M-Phase von MDA-MB-468 auf 69 %, vermittelt durch eine Reduktion der CDK1- und Chk1-Expression. Es induziert Apoptose in TNBC, teilweise durch Inaktivierung und Herunterregulierung von Akt und Bcl-xL. Es führt zu einer Proteasom-vermittelten Reduktion der IRAK-1- und TBK1-Spiegel, was zu einer Reduktion der NF-κB-Aktivität in MDA-MB-231-Zellen, die mit 0,5 und 1 μM PU-H71 behandelt wurden, um ca. 84 % bzw. 90 % führt. Es hemmt die Invasion von MDA-MB-231-Zellen deutlich, mit einer 90 %igen Unterdrückung bei 1 μM. Bei 2,5 μM erzeugt es endoplasmatisches Retikulum (ER)-Stress und aktiviert die Unfolded Protein Response (UPR), wie durch XBP1-mRNA-Spleißen (2,3-fach) und Hochregulierung der Grp94- (3,7-fach), Grp78- (4,9-fach) und CHOP- (48-fach) Proteinexpression sowie ATF4- (1,8-fach) mRNA-Expression belegt. Bei 1 μM induziert es den mitochondrialen Apoptoseweg in HeLa-Zellen, vermittelt durch Caspase, aber nicht durch Calpain-Aktivierung. Als Reaktion auf PU-H71-induzierten ER-Stress wird Apoptose in Melanom-, Gebärmutterhals-, Darm-, Leber- und Lungenkrebszellen ausgelöst, jedoch nicht in normalen menschlichen Fibroblasten. Es ist in der Lage, Apoptose zu induzieren und die durch Bcl-2 verliehene Resistenz zu überwinden. Bei 30 nM reduziert es signifikant die NOS2-Aktivität (60 % Reduktion) und Expression in LI (1 μg/mL LPS und 5 ng/mL IFN γ)-stimulierten Astrozyten durch Hemmung der NF-κB-Elementaktivierung. Es zeigt ähnliche Effekte auf Mikrogliazellen wie auf Astrozyten, wobei 50 nM PU-H71 benötigt werden, um die LPS-abhängige Nitritfreisetzung signifikant zu reduzieren.
|
| Kinase-Assay |
HSP90-Bindungsassay
|
|
Messungen werden in schwarzen 96-Well-Mikrotiterplatten durchgeführt. Zelllysate werden durch Zerstörung der Zellmembranen durch Einfrieren bei -70 °C und Auflösen des Zellextrakts in HFB [20 mM Hepes (K), pH 7,3, 50 mM KCl, 5 mM MgCl2, 20 mM Na2MoO4, 0,01 % Nonidet P-40] mit zugesetzten Protease- und Phosphataseinhibitoren hergestellt. Sättigungskurven werden aufgezeichnet, wobei fluoreszenzmarkiertes Geldanamycin (Cy3B-GM) (3 nM) mit zunehmenden Mengen zellulärer Lysate behandelt wird. Die Menge an Lysat, die zu Polarisations-(mP)-Messwerten führt, die 90 %-99 % gebundenem Liganden entsprechen, wird für die Kompetitionstudie ausgewählt. Hier enthält jede 96-Well-Platte 3 nM Cy3B-GM, Zelllysat (Mengen, wie bestimmt und normalisiert auf Gesamt-Hsp90, bestimmt durch Western-Blot-Analyse unter Verwendung von aus HeLa-Zellen gereinigtem Hsp90 als Standard) und getesteten Hsp90-Inhibitor in einem Endvolumen von 100 μL. Die Platte wird 24 Stunden lang auf einem Schüttler bei 4 °C belassen, und die Fluoreszenzpolarisations-(FP)-Werte in mP werden aufgezeichnet. EC50-Werte für Zelavespib (PU-H71) werden als die Konzentrationen des Kompetitors bestimmt, bei denen 50 % des Cy3B-GM verdrängt werden. FP-Messungen werden auf einem Analyst GT Mikrotiterplattenlesegerät durchgeführt.
|
|
| In vivo |
S8039, verabreicht mit 75 mg/kg a.d. im MDA-MB-231-Modell, induziert eine 100 %ige vollständige Remission, und Tumore werden nach 37 Behandlungstagen zu Narbengewebe reduziert, begleitet von einer Reduktion vieler proliferativer und anti-apoptotischer Moleküle, nämlich einer 80%igen, 95%igen, 99%igen, 80%igen und 65%igen Abnahme von EGFR, HER3, Raf-1, Akt bzw. p-Akt. S8039 (75 mg/kg, 3 Mal pro Woche) induziert eine 96%ige Hemmung des Tumorwachstums, begleitet von einer 60%igen Reduktion der Tumorzellproliferation, einem 85%igen Rückgang des aktivierten Akt, der mit Überleben und hohem invasivem Potenzial assoziiert ist, und einer 6-fachen Zunahme der Apoptose.
|
Literatur |
|
Anwendungen
| Methoden | Biomarker | Bilder | PMID |
|---|---|---|---|
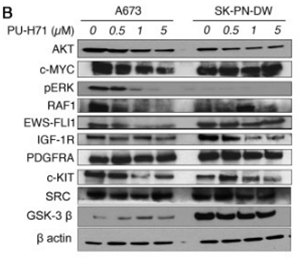
| Western blot | AKT / c-Myc / pERK / RAF1 / EWS-FLI1 / IGF-1R / PDGFRA / c-KIT / SRC EGFR / HER3 / IGF-1R / c-Kit / Raf-1 / Akt / p90RSK / CSK / Hsp70 / Hsp90 Bcl-xl / p-PDK1 / p-AKT / cPARP LYN / SYK / BTK / AKT / MEK / ERK |
|
24388362 |
| Growth inhibition assay | Cell viability |
|
19416831 |
Klinische Studieninformationen
(Daten von https://clinicaltrials.gov, aktualisiert am 2024-05-22)
| NCT-Nummer | Rekrutierung | Erkrankungen | Sponsor/Kooperationspartner | Startdatum | Phasen |
|---|---|---|---|---|---|
| NCT05612633 | Withdrawn | Accelerated Phase MPN|Blast Phase MPN |
Samus Therapeutics Inc. |
June 15 2022 | Phase 2 |
| NCT03935555 | Terminated | Primary Myelofibrosis (PMF)|Post-Polycythemia Vera Myelofibrosis (Post-PV MF)|Post-Essential Thrombocythemia Myelofibrosis (Post-ET MF) |
Samus Therapeutics Inc. |
August 12 2019 | Phase 1 |
| NCT03373877 | Terminated | Myelofibrosis|Primary Myelofibrosis|Post-polycythemia Vera Myelofibrosis|Post-essential Thrombocythemia Myelofibrosis |
Samus Therapeutics Inc. |
May 24 2018 | Phase 1 |
| NCT01393509 | Completed | Metastatic Solid Tumor|Lymphoma|Myeloproliferative Neoplasms (MPN) |
Memorial Sloan Kettering Cancer Center |
July 6 2011 | Phase 1 |
| NCT01581541 | Terminated | Solid Tumors|Lymphoma |
National Cancer Institute (NCI)|National Institutes of Health Clinical Center (CC) |
April 26 2011 | Phase 1 |
Technischer Support
Tel: +1-832-582-8158 Ext:3
Wenn Sie weitere Fragen haben, hinterlassen Sie bitte eine Nachricht.
