nur für Forschungszwecke
AMD3465 hexahydrobromide CXCR Antagonist
Kat.-Nr.S2879
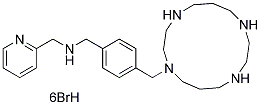
Chemische Struktur
Molekulargewicht: 896.07
Qualitätskontrolle
- In Nature Medicine für seine erstklassige Qualität zitiert
- COA
- NMR
- HPLC
- SDS
- Datenblatt
| Verwandte Ziele | Hedgehog/Smoothened PKA Adrenergic Receptor AChR 5-HT Receptor Histamine Receptor Dopamine Receptor Ras KRas GPR |
|---|---|
| Weitere CXCR Inhibitoren | AZD5069 SB 225002 Reparixin (Repertaxin) WZ811 Navarixin (SCH-527123) LIT-927 AMG 487 SX-682 LY2510924 Danirixin (GSK1325756) |
Chemische Informationen, Lagerung & Stabilität
| Molekulargewicht | 896.07 | Formel | C24H38N6.6HBr |
Lagerung (Ab dem Eingangsdatum) | |
|---|---|---|---|---|---|
| CAS-Nr. | 185991-07-5 | SDF herunterladen | Lagerung von Stammlösungen |
|
|
| Synonyme | N/A | Smiles | C1CNCCNCCCN(CCNC1)CC2=CC=C(C=C2)CNCC3=CC=CC=N3.Br.Br.Br.Br.Br.Br | ||
Löslichkeit
|
In vitro |
Water : 98 mg/mL
DMSO
: 2 mg/mL
(2.23 mM)
Ethanol : Insoluble |
Molaritätsrechner
|
In vivo |
|||||
In-vivo-Formulierungsrechner (Klare Lösung)
Schritt 1: Geben Sie die untenstehenden Informationen ein (Empfohlen: Ein zusätzliches Tier zur Berücksichtigung von Verlusten während des Experiments)
Schritt 2: Geben Sie die In-vivo-Formulierung ein (Dies ist nur der Rechner, keine Formulierung. Bitte kontaktieren Sie uns zuerst, wenn es im Abschnitt "Löslichkeit" keine In-vivo-Formulierung gibt.)
Berechnungsergebnisse:
Arbeitskonzentration: mg/ml;
Methode zur Herstellung der DMSO-Stammlösung: mg Wirkstoff vorgelöst in μL DMSO ( Konzentration der Stammlösung mg/mL, Bitte kontaktieren Sie uns zuerst, wenn die Konzentration die DMSO-Löslichkeit der Wirkstoffcharge überschreitet. )
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügenμL PEG300, mischen und klären, dann hinzufügenμL Tween 80, mischen und klären, dann hinzufügen μL ddH2O, mischen und klären.
Methode zur Herstellung der In-vivo-Formulierung: Nehmen Sie μL DMSO Stammlösung, dann hinzufügen μL Maisöl, mischen und klären.
Hinweis: 1. Bitte stellen Sie sicher, dass die Flüssigkeit klar ist, bevor Sie das nächste Lösungsmittel hinzufügen.
2. Achten Sie darauf, das/die Lösungsmittel der Reihe nach hinzuzufügen. Sie müssen sicherstellen, dass die bei der vorherigen Zugabe erhaltene Lösung eine klare Lösung ist, bevor Sie mit der Zugabe des nächsten Lösungsmittels fortfahren. Physikalische Methoden wie Vortex, Ultraschall oder ein heißes Wasserbad können zur Unterstützung des Lösens verwendet werden.
Wirkmechanismus
| Targets/IC50/Ki |
CXCR4
|
|---|---|
| In vitro |
AMD3465 blockiert die Bindung von CXCL12 mit einer IC50 von 18 nM in SupT1-Zellen. AMD3465 hemmt die CXCL12-induzierte Kalziumsignalisierung in SupT1-Zellen mit einer IC50 von 17 nM und hemmt auch die MAPK-Phosphorylierung. AMD3465 konnte jedoch die durch die CCR5-Liganden RANTES, LD78β und MIP-1β in U87.CD4.CCR5-Zellen ausgelösten intrazellulären Kalziumflüsse nicht blockieren. AMD3465 unterdrückt die CXCL12-induzierte Chemotaxis menschlicher T-lymphatischer SupT1-Zellen und verhindert die Chemokin-induzierte Internalisierung von CXCR4 in U87.CD4-Zellen. Darüber hinaus erweist sich AMD3465 als wirksam gegen die X4-HIV-1-Stämme IIIB, NL4.3, RF und HE mit einer IC50 von 6-12 nM. AMD3465 unterdrückt die HIV-2-Stämme ROD und EHO mit einer IC50 von 12,3 nM. AMD3465 hemmt die SDF-1α-Ligandenbindung mit einem Ki von 41,7 nM unter Verwendung der CCRF-CEM-Zelllinie. Die Hemmung der CXCR4-Signalwege durch AMD3465 wird durch die Hemmung des SDF-1α-stimulierten Kalziumflusses und der GTP-Bindung mit einer IC50 von 12,07 nM bzw. 10,38 nM demonstriert. Darüber hinaus ist AMD3465 in der Lage, die CXCR4-vermittelte physiologische Reaktion, die Zellchemotaxis, mit einer IC50 von 8,7 nM zu hemmen. Darüber hinaus hat AMD3465 keine hemmende Wirkung auf MIP1α, MCP-1, TARC, RANTES, MIP-3β oder IP10-vermittelte Kalziumflüsse, Liganden für CCR1, CCR2b, CCR4, CCR5, CCR7 bzw. CXCR3, oder LTB4-Bindung an BLT1, was darauf hinweist, dass AMD3465 ein selektiver Inhibitor von CXCR4 gegenüber anderen Chemokinrezeptoren ist. In einer separaten Studie wird gezeigt, dass AMD3465 die SDF-1-vermittelte CXCR4-Internalisierung in Zellen, die GFP-verknüpftes CXCR4 exprimieren, hemmt und keine Rezeptorinternalisierung verursacht, wenn es allein mit den Zellen inkubiert wird.
|
| In vivo |
Die Pharmakokinetik von AMD3465 wird an Mäusen und Hunden untersucht. Die Absorption ist nach subkutaner Verabreichung schnell. AMD3465 wird biphasisch aus dem Hundeplasma eliminiert, mit einer terminalen Halbwertszeit von 1,56-4,63 h. AMD3465 zeigt nach subkutaner Verabreichung eine 100%ige Bioverfügbarkeit im Vergleich zur Exposition gegenüber den intravenösen und subkutanen Dosen. AMD3465 verursacht Leukocytosis, wenn es subkutan bei Mäusen und Hunden verabreicht wird, wobei die maximale Mobilisierung zwischen 0,5 h und 1,5 h nach subkutaner Dosierung bei Mäusen auftritt und die maximale Plasmakonzentration der Verbindung der Spitzenmobilisierung bei Hunden vorausgeht, was darauf hindeutet, dass AMD3465 das Potenzial hat, hämatopoetische Stammzellen zu mobilisieren. AMD3465 hebt die Bildung von Typ-2-Granulomen und die Eosinophilmobilisierung bei Dosen von 6 und 30 mg/kg auf. Eine AMD3465-Behandlung könnte eine ~90%ige Reduzierung der CXCR4-Transkriptspiegel in Lungen mit Typ-2-Läsionen verursachen.
|
Literatur |
|
Technischer Support
Tel: +1-832-582-8158 Ext:3
Wenn Sie weitere Fragen haben, hinterlassen Sie bitte eine Nachricht.
